

科研动态

近日,国际权威期刊Journal of the American Chemical Society(JACS)在线发表了上海交通大学生命科学技术学院/张江高等研究院瞿旭东团队与上海交通大学生命科学技术学院罗树坤团队的合作成果“Terminal Carboxyl Editing Drives Divergence in Fasamycin and Anthrabenzoxocinone Biosynthesis”。瞿旭东教授、罗树坤特别研究员为论文的共同通讯作者,博士后姜凯为本文的第一作者。
芳香聚酮是一大类具有重要生物活性的天然产物。它们的生物合成主要由II型聚酮合成酶(PKSs)负责,其催化丙二酰辅酶A发生脱羧克莱森缩合,生成碳原子数为16至30的偶数碳链。随后,芳构化酶/环化酶(ARO/CYC)控制碳链折叠形成基本的偶数碳芳香骨架。这些骨架作为母核,经过进一步的PKS后修饰,产生复杂多样的聚酮结构。然而,尽管存在多种偶数碳基本骨架,奇数碳芳香聚酮仍广泛存在,而末端羧基的去留决定了最终产物的碳数和结构。因此,发现能够编辑聚酮碳链末端羧基的机制,对于扩展芳香聚酮的结构多样性和功能多样性至关重要。
(+)/(−)-Anthrabenzoxocinones(ABXs)和Fasamycin(FAS)是一类对耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素屎肠球菌(VRE)具有高效活性的II型聚酮化合物。它们具有非平面、手性的25碳结构,源于一个共同的26碳前体——化合物1(图1)。近期课题组已阐明该前体涉及的两条合成路径:其一,在独特的ARO/CYC FasU催化下,经历一步酶促脱羧环化步骤,形成FAS的轴手性联苯结构(E环)(J. Am. Chem. Soc. 2025, 147, 5596-5601);其二,该前体末端脱羧形成phenyldimethylanthrone(PDA)(Proc. Natl. Acad. Sci. USA 2024, 121, e2321722121),随后PDA通过双氧杂Diels-Alder反应转化为(−)-ABX的手性氧桥结构(E环)(Nat. Chem., 2025, 17, 1058-1066)。然而,该前体的不稳定性使得生物合成途径更为复杂:化合物1能自发脱羧形成PDA,或自发环化产生副产物fasamycin F(FAS-F)。对于FAS的生产,稳定前体对于避免脱羧至关重要;而对于ABX的合成,则需要快速脱羧以防止FAS-F的形成。这种微妙的平衡暗示存在一种精密的末端羧基编辑机制。
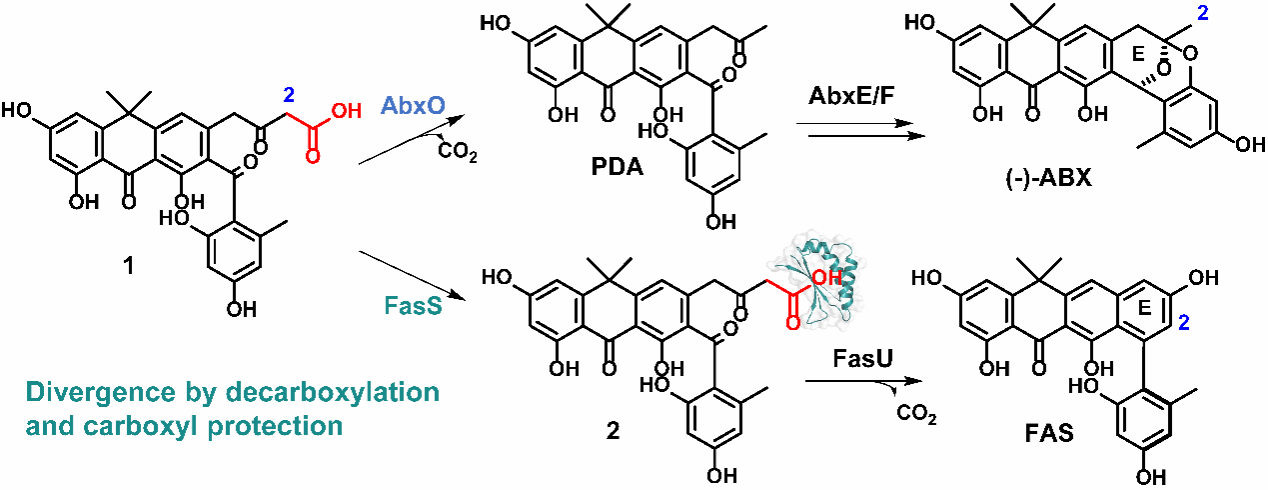
图1. II型芳香聚酮ABX和FAS的生物合成途径分化过程。聚酮链末端羧基的去留在芳香骨架多样化方面发挥了关键作用。
在本项研究中,联合课题组首先在体外研究了FAS途径中的单加氧酶家族蛋白FasS和ABX途径中的SchA/CurD家族蛋白AbxO的功能。通过调节体外酶反应体系的温度,并结合脱羧环化酶FasU组合催化,发现FasS作为首个羧基保护蛋白保护化合物1的末端羧基,使其允许FasU的后续环化。相反,AbxO作为首个线性末端聚酮链脱羧酶,负责化合物1脱羧产生PDA,这是ABX形成的关键中间体。系统发育分析和功能研究证实,FasS和AbxO与广泛分布但功能未知的WhiE-ORFI家族蛋白的N端和C端密切相关。为了深入理解FasS独特的羧基保护机制和AbxO的脱羧机制,联合课题组又解析了FasS、AbxO和WhiE-ORFI的晶体结构。通过对FasS和AbxO活性位点的定点突变,揭示了关键的功能残基。对FasS进一步的ITC测试,并结合分子动力学模拟(MD)分析,表明了FasU和FasS之间的相互作用促进了化合物1的解离过程。这部分工作不仅首次揭示了II型聚酮生物合成中隐秘的末端羧基编辑方式,还为未来产生新型奇数碳芳香聚酮骨架提供了重要思路。
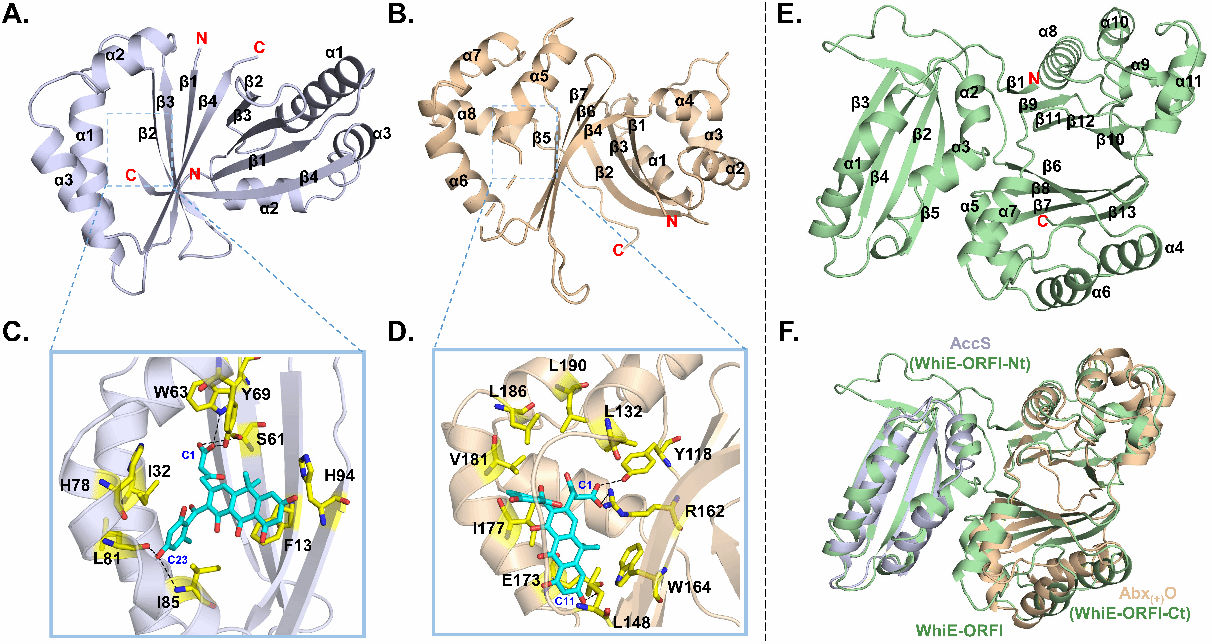
图2. AccS(FasS同源蛋白)、Abx(+)O和WhiE-ORFI的晶体结构及其底物结合和催化机制。(A) AccS的晶体结构。(B) AbxO的晶体结构。(C) AccS和1的底物结合模式。(D) AbxO和1的底物结合模式。(E) WhiE-ORFI的晶体结构。(F) AccS和AbxO分别与WhiE-ORFI的N端和C端结构叠加。
该研究工作受到了国家自然科学基金(32425033,22377074,22107069),上海市优秀学术带头人项目(22XD1421300)以及上海市自然科学基金项目(23ZR1432800)的支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c06089





 交大主页
交大主页