

科研动态

北京时间2025年10月2日,上海交通大学生命科学技术学院/张江高等研究院/中科院上海有机化学研究所刘文教授课题组联合中科院上海有机化学研究所潘李锋研究员、薛小松研究员、西安交通大学马鹏琛教授,在天然产物生物合成领域取得重大进展。相关研究成果以 “Pseudokinases can catalyse peptide cyclization through thioether crosslinking” 为题在线发表在学术期刊 Nature Chemistry 上,开启了假激酶领域的新认知。
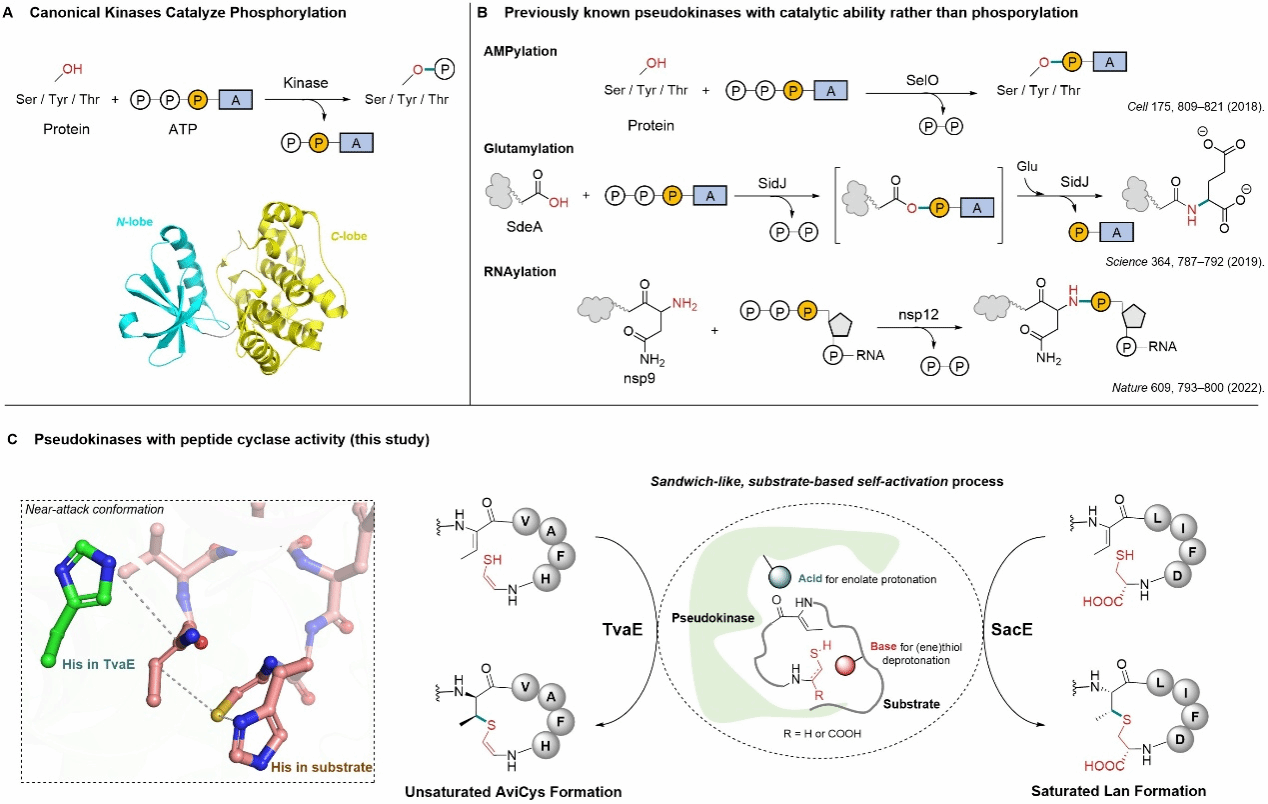
该研究首次发现,细菌中的假激酶能够直接催化肽分子环化,形成不饱或饱和的硫醚交联结构。这一发现突破了假激酶的“非激酶”催化功能认知,显示了蛋白激酶超家族在进化中的功能重塑潜力。研究团队通过晶体学与多尺度理论计算,进一步提出了独特的“夹层式底物辅助”机制,为环状肽类天然产物的高效合成提供了新策略。
蛋白激酶超家族拥有超过70个家族、数百万成员,是最重要的酶类之一,其典型功能是ATP依赖的蛋白磷酸化。缺乏关键残基的假激酶长期被认为无催化功能,仅起到信号调控等作用。此前,只有少数假激酶被发现具有非典型功能,如AMP化、谷氨酰化或RNA修饰,然而,这些反应均依赖高能磷酸键的水解,其功能范围依然十分有限。
本研究中,团队聚焦两类富硫细菌环肽:硫酰胺肽(thioamitides)和羊毛硫肽(lanthipeptides)。结果显示,在硫酰胺肽途径中,假激酶 TvaE 能催化末端烯硫醇与脱水苏氨酸残基发生 Michael 加成,形成 AviCys 环化结构;在羊毛硫肽途径中,假激酶 SacE 也能选择性催化饱和硫醚键生成,说明假激酶催化环化的功能并非个例,而可能在多种天然产物中普遍存在。
晶体学研究显示,TvaE 与底物肽结合后补全了激酶的结构,形成了不依赖ATP的活性中心。结合分子建模、分子动力学模拟与 QM/MM 计算,研究团队提出了“夹层式底物辅助”的酶促反应机制:肽底物上的 His残基 作为碱完成硫醇的去质子化,促进其与上游脱氢氨基酸之间的加成后 ,TvaE活性中心 的 His 残基作为酸通过质子化完成反应,最终生成立体构型专一的硫醚环化结构。
这一成果不仅丰富了对假激酶功能的理解,也为富硫环肽的生物合成及新型抗癌、抗菌药物研发提供了新工具和理论依据。
论文共同第一作者为胡玲、李淼、桑岳千和赵成欣;上海交通大学生命科学技术学院/张江高等研究院/中科院上海有机化学研究所刘文教授、中科院上海有机化学研究所潘李锋研究员、薛小松研究员、西安交通大学马鹏琛教授为共同通讯作者。上海交通大学为论文第一完成单位。这项工作得到国家自然科学基金委、科技部、上海市科学技术委员会等资助。
专家点评(北京大学 雷晓光教授)
环肽因其独特的空间结构和生物活性,近年来在口服药物、多肽偶联药物、诊断试剂等领域展现出巨大的应用潜力。然而环肽分子的高效合成还存在很大挑战。自然界中存在很多环肽类天然产物,其中非核糖体产生肽和核糖体产生的翻译后修饰肽是主要的天然环肽来源。RiPPs构造中的关键成环过程一直以来都是相关生物合成研究中的热点和难点,对于催化机制独特的环化反应酶的发现有助于帮助高效构造结构多样性的环肽分子。
近日,刘文等科研团队在Nature Chemistry杂志上报道的最新合作研究,阐明了硫酰胺类化合物(thioamitides)和羊毛硫肽(lanthipeptides)这两类重要天然产物中关键的分子内环化过程是如何形成的这一关键科学问题。本研究开拓性地发现了假激酶的全新催化机制——"三明治样底物辅助"的迈克尔加成反应。这完全不同于已知的假激酶功能模式。研究揭示了TvaE和SacE这两个假激酶的独特工作机制。以TvaE为例,它与前导肽序列结合形成完整的蛋白激酶折叠结构,这种结构互补是TvaE发挥催化活性的关键。此外,底物肽段中的组氨酸残基(H86)直接参与催化反应,充当碱催化剂激活烯硫醇基团。这种底物辅助催化机制在激酶超家族中极为罕见。这一发现打破了长期以来对假激酶“无催化功能”的传统认识,揭示了蛋白激酶样家族在进化中的“再利用”潜力,也为环状肽类天然产物的生物合成和工程化提供了新思路。
文章链接:https://doi.org/10.1038/s41557-025-01954-1





 交大主页
交大主页