

科研动态

病理蛋白通过液-固相变形成的病理蛋白纤维聚集体是多种神经退行性疾病(neurodegenerative diseases, NDs)的重要病理标志。不同蛋白形成的病理性聚集体在不同的NDs中被发现具有多种不同的病理毒性,包括:激活神经炎症、打破蛋白稳态、引发线粒体损伤、跨脑区及跨器官传播等。因此,对于病理蛋白聚集体的组成结构,聚集机理及病理毒性的研究对于理解NDs的致病机制及药物研发具有重要意义。
2022年4月27日,上海交通大学超快科学中心长聘副教授李丹课题组(Bio-X研究院)与复旦大学附属华山医院王坚课题组、上海有机所生物与化学交叉研究中心刘聪课题组合作在Cell Research在线发表题为“Generic amyloid fibrillation of TMEM106B in patient with Parkinson's disease dementia and normal elders”的研究成果。在这项研究中,研究人员直接从一位伴有痴呆的帕金森病患者(Parkinson’s disease dementia, PDD)及两位高龄健康对照者的脑组织中提取并发现一种之前未知的全新病理蛋白聚集体,进一步通过冷冻电镜及质谱等方法揭示这种全新的蛋白病理聚集体是由跨膜蛋白106B(transmembrane protein 106B, TMEM106B)折叠成新颖的冰壶状片层结构单元并进一步自组装形成。本工作发现了在ND病人及健康老年人脑中共同存在的一类全新病理蛋白纤维聚集体,并讨论了新发现的蛋白聚集体在NDs及衰老中的作用。

李丹课题组长期致力于研究帕金森病关键蛋白α-synuclein (α-syn) 的液-固相变与聚集的分子机理、发展化学干预和示踪的新方法。通过发展包括冷冻电镜三维螺旋重构技术及电子衍射技术手段系统地研究并发现了不同的内在及外在条件可以诱导α-syn通过液-固相变形成具有不同三维结构的病理蛋白聚集体。然而,之前的研究主要基于体外制备的α-syn蛋白聚集体展开。在本工作中,李丹课题组与合作者密切合作,首次尝试从PDD患者脑组织中直接提取α-syn病理蛋白聚集体,并通过多步纯化最终从脑组织成功提取获得蛋白纤维聚集体(图1)。然而,令人惊讶的是,从PDD脑组织提取的蛋白纤维聚集体并非由α-syn形成。进一步,研究人员通过冷冻电镜及质谱等技术手段鉴定这个全新的蛋白聚集体是由之前缺乏关注与研究的TMEM106B蛋白形成的。
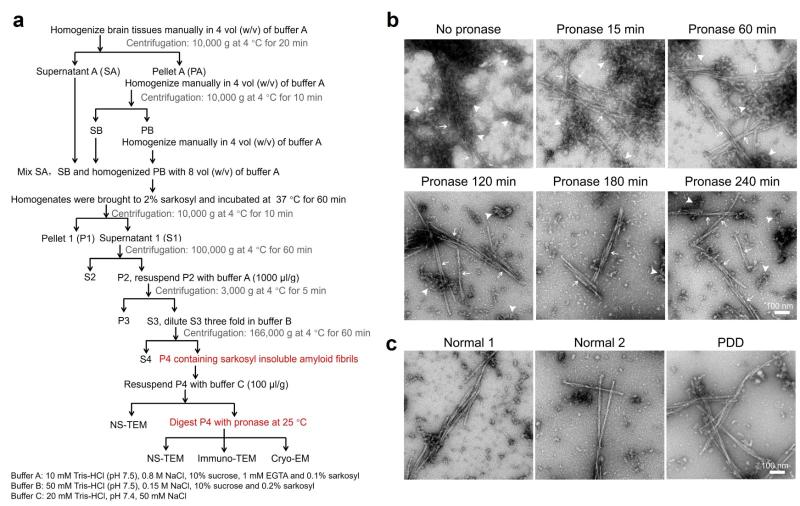
图1. 人脑组织蛋白纤维聚集体提取方法及结果
更为有趣的是,除了PDD患者的脑组织,研究人员同时从另外两例高龄健康对照者脑组织中提取获得同样由TMEM106B形成的蛋白纤维聚集体。进一步的研究发现, TMEM106B在PDD及两例健康对照脑组织中形成有别于其天然构象的全新冰壶状构象并组装形成具有β-折叠片层结构的纤维聚集体。但TMEM106B的局部构象在三种不同来源的纤维聚集体中又存在细微的差别。在2号健康对照中,TMEM106B呈现单股原纤维组成的Type 1结构(图2);在1号健康对照中为单股原纤维组成的Type 2结构;在PDD中同时存在两种结构的TMEM106B纤维,一种为与1号健康对照相同的Type 1结构,另一种为由两股与Type 1结构相同的原纤维组成的Type 3结构。Type 1和Type 2纤维聚集体均由TEME106B的C端结构域(Residue 120-254)组成,形成一个含有17个β-片层的冰壶状构型(图2)。
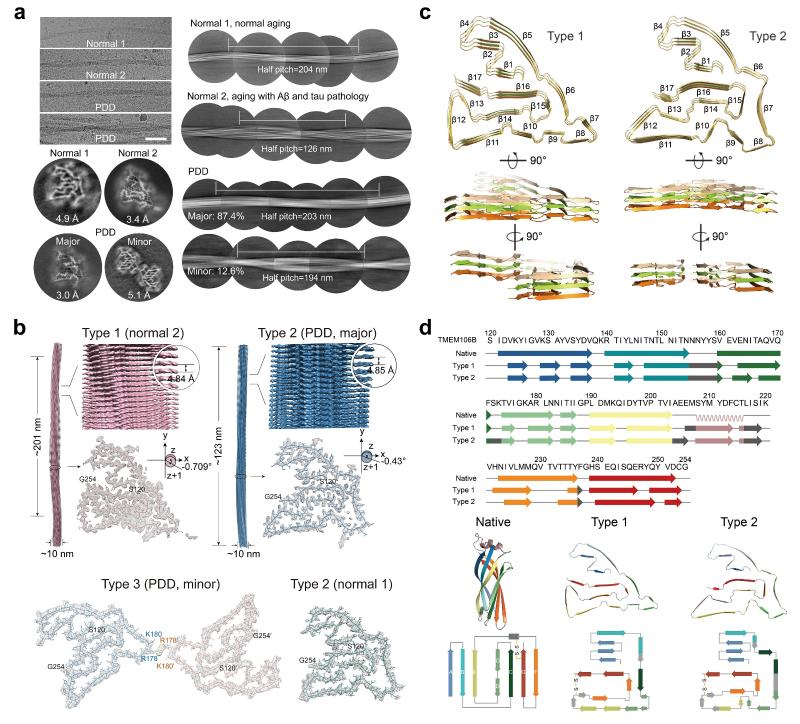
图2. PDD患者和高龄健康对照脑组织TMEM106B纤维聚集体冷冻电镜结构
值得一提的是,我院长聘教轨副教授曹骎近期在Nature发表了类似的发现1(https://mp.weixin.qq.com/s/XvdcLufikKw-U3oeSBi5MQ)。在过去的1个多月时间里,哥伦比亚大学Fitzpatrick课题组和剑桥大学Goedert&Scheres课题组也陆续在Cell及Nature报道了相关的研究成果2,3。但是,以上三个工作对于TMEM106B纤维聚集体的病理意义存在较大的争议。在本工作中,研究人员综合分析了本工作及以上三个工作中报道的用来提取TMEM106B纤维聚集体的脑组织捐赠者年龄在不同亚群中的分布特征,发现无论是以家族性及散发性NDs分类,还是以不同类别的NDs分类,NDs患者的年龄均显著低于健康对照组(图3)。据此,提出了疾病与年龄共同作为TMEM106B病理纤维聚集形成的两个关键驱动因素。
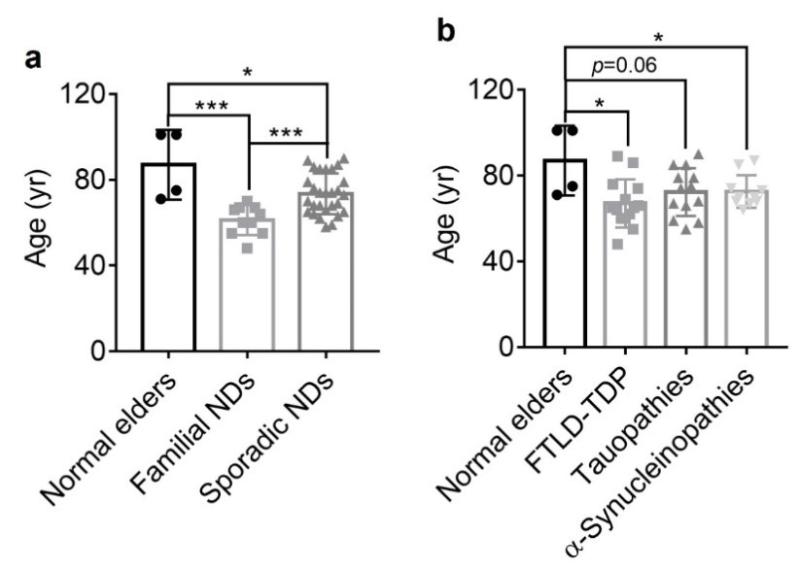
图3. 含有TMEM106B纤维的脑组织捐赠者的年龄统计分析图
综上,本研究工作从PDD患者及高龄健康对照中脑组织中意外发现一类全新的由TMEM106B蛋白形成的病理纤维聚集体,并讨论TMEM106B纤维的形成与疾病、衰老的直接关系。本工作为理解不同蛋白病理聚集体在疾病及衰老中的复杂作用提供了新的认识;为进一步探索人脑中存在的不同蛋白聚集体的纷繁复杂的病理及生理活性开拓了新的思路;也为识别病理蛋白聚集体的PET示踪剂的研发提出新的挑战。
上海交通大学Bio-X研究院研究生赵钦玥为该论文的共同第一作者,另外两位第一作者为复旦大学附属华山医院研究生范云和上海有机所生物与化学交叉研究中心研究生夏文程。论文的合作单位有上海交通大学、复旦大学附属华山医院以及上海有机所生物与化学交叉研究中心。
文章链接:https://www.nature.com/articles/s41422-022-00665-3#Sec1
参考文献:
1. Jiang, Y. X. et al. Amyloid fibrils in disease FTLD-TDP are composed of TMEM106B not TDP-43. Nature, doi:10.1038/s41586-022-04670-9 (2022).
2. Chang, A. et al. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell 185, 1346-1355.e1315, doi:10.1016/j.cell.2022.02.026 (2022).
3. Schweighauser, M. et al. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature, doi:10.1038/s41586-022-04650-z (2022).





 交大主页
交大主页