

科研动态

近日,英国皇家科学院院士、上海交通大学材料科学与工程学院及张江高等研究院Stephen Mann讲席教授以通讯作者身份在国际著名期刊《Nature》最新一期上在线发表了名为“Living material assembly of bacteriogenic protocells”的研究成果,该研究基于单个凝聚体微滴以进行空间可控组装和原位裂解细菌菌落的活性材料组装工艺,实现一个以原核细胞为灵感的真核细胞仿生系统的产生,在人造细胞研究领域取得了重大突破。

在人造细胞中“还原”活细胞类似的功能是一项全球性的巨大挑战,其跨越了包括合成生物学、生物工程学以及生命起源研究在内的多个领域。传统的微区室化方法难以在人造细胞模型中建立足够的组成多样性和生物化学互补性,其功能性也比较单一。如何解决目前人造细胞模型在结构复杂性和功能多样性等方面的局限,发展新型仿生细胞系统是人造细胞等领域亟待攻克的难点。本研究创新性地提出了一种基于聚合物-三磷酸腺苷凝聚体微滴以进行空间可控组装和原位裂解细菌菌落的方法,成功地构建了有膜且分子密集、成分和形态复杂的人造细胞,第一个基于原核细胞的真核细胞样人造细胞就此诞生。该工作极具挑战性,在Stephen Mann教授指导下,由博士后徐灿负责完成。本文另一位通讯作者为Mei Li教授。
本研究通过构建凝聚物隔层作为人造细胞的结构骨架,利用细菌本身继承不同生物成分的特点,人为地对其进行了内源性地重塑,在人造细胞内部搭建了包括DNA-组蛋白核状凝聚物、膜化水泡和F-肌动蛋白原细胞骨架丝为核心的三维立体网络。结果表明,F-肌动蛋白作为一种细胞骨架蛋白,可在人造细胞的“细胞质”中进行酶促聚合从而产生丝状网络。该网络状结构在有效提高人造细胞稳定性的同时,研究团队惊喜地发现,随着其内部代谢物质的积累,人造细胞的形状由原本的球形逐步发展为不规则的变形虫状细胞形态。不仅如此,人造细胞在保持内部结构复杂性的同时,其细胞膜可以被细菌来源的磷脂不断修复,密封性得以大大增强。
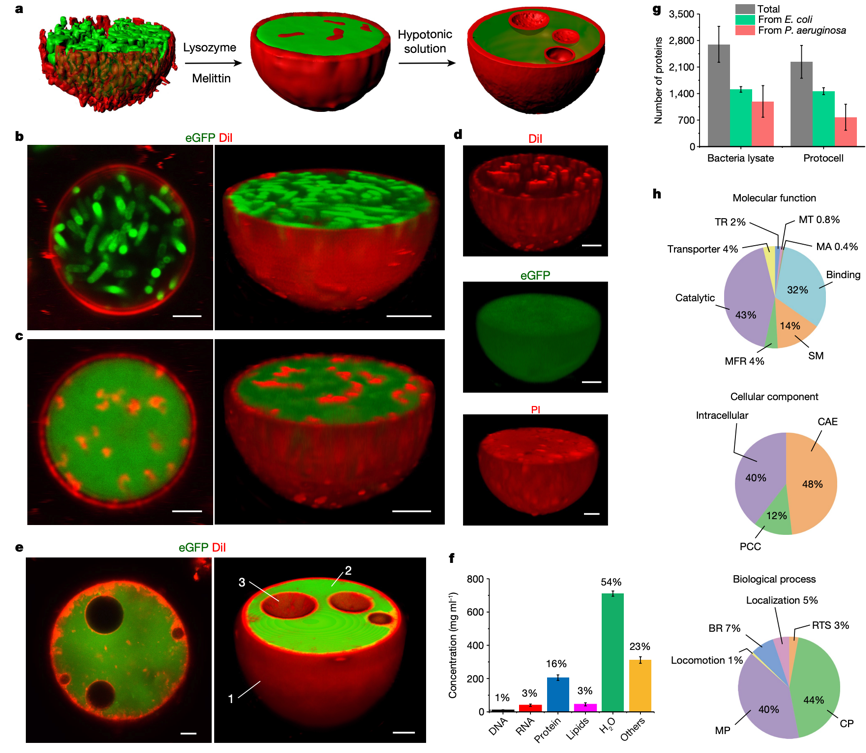
图1. 细菌源性人造细胞的构建
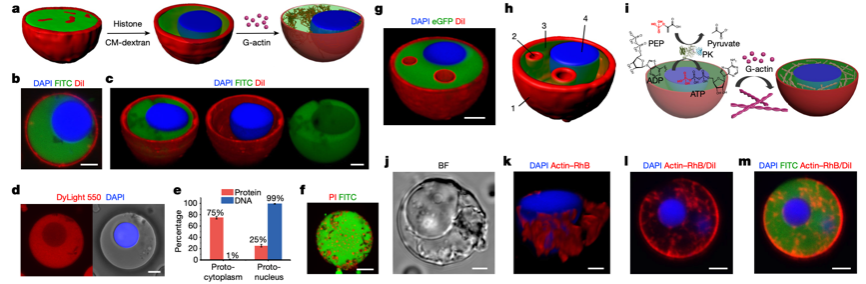
图2. 细菌源性人造细胞的原位增殖
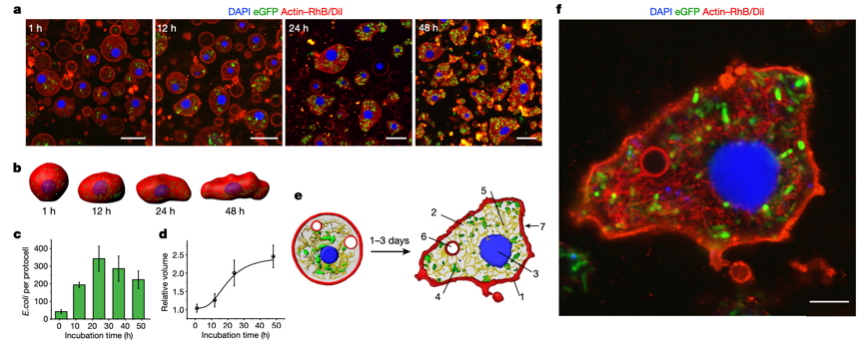
图3. 细菌源性人造细胞发生活细胞介导的形态改变
该研究首次创立了基于原核细胞的新型人造细胞构建系统,不仅为构建复杂性更高的真核细胞仿生系统提供了设计理念和技术手段,也为探讨生命起源等方面的科学研究提供了一定的思路和灵感,更为合成生物学和生物工程学等多学科的交叉融合与互作发展提供了良好的机会与平台,具有令人兴奋的研究潜力与发展前景。





 交大主页
交大主页