

科研动态

近日,上海交通大学张江高等研究院超快科学中心李丹教授团队合作华山医院王坚教授团队发表了题目为“Conformational change of α-synuclein fibrils in cerebrospinal fluid from different clinical phases of Parkinson’s disease”的研究论文,揭示了α-突触核蛋白(α-synuclein,α-syn)病理聚集纤维在帕金森病(Parkinson’s disease,PD)疾病的不同阶段存在的构象转变过程。该成果2023.1发表在Cell子刊《结构》(Structure)期刊,并被国际知名神经退行性疾病论坛ALZFORUM撰文报道。

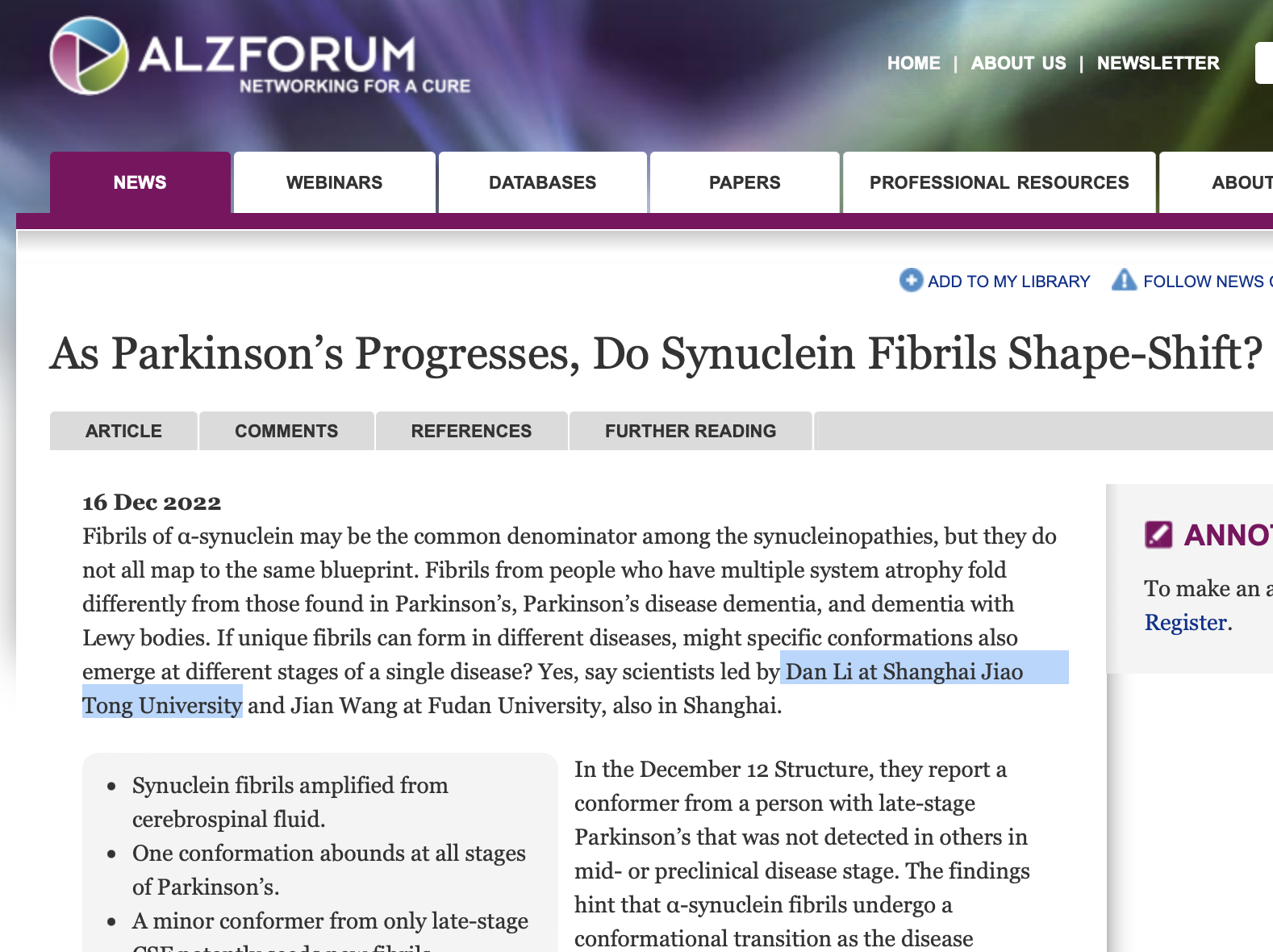
α-Syn蛋白的病理性聚集是PD及多种突触核蛋白病的主要病理标志。α-Syn病理性淀粉样纤维聚集在细胞间的传递和不同脑区间的扩散过程与PD的发生发展紧密相关。已发现α-Syn淀粉样纤维在体外和体内可以形成多种不同的聚集结构,并呈现不同的病理特性。α-Syn淀粉样病理纤维的这种结构多态性被认为是导致突触核蛋白病临床特征异质性的主要原因和分子基础。然而,目前关于α-syn聚集在PD疾病发展不同阶段的是否存在构象转化,以及其在病理传播和神经变性中的作用,仍知之甚少。因此,探究PD进程中不同阶段α-syn纤维结构的多态性,对于理解PD的病理形成和传播机制具有至关重要的意义,对相关治疗手段的研发具有重要价值。
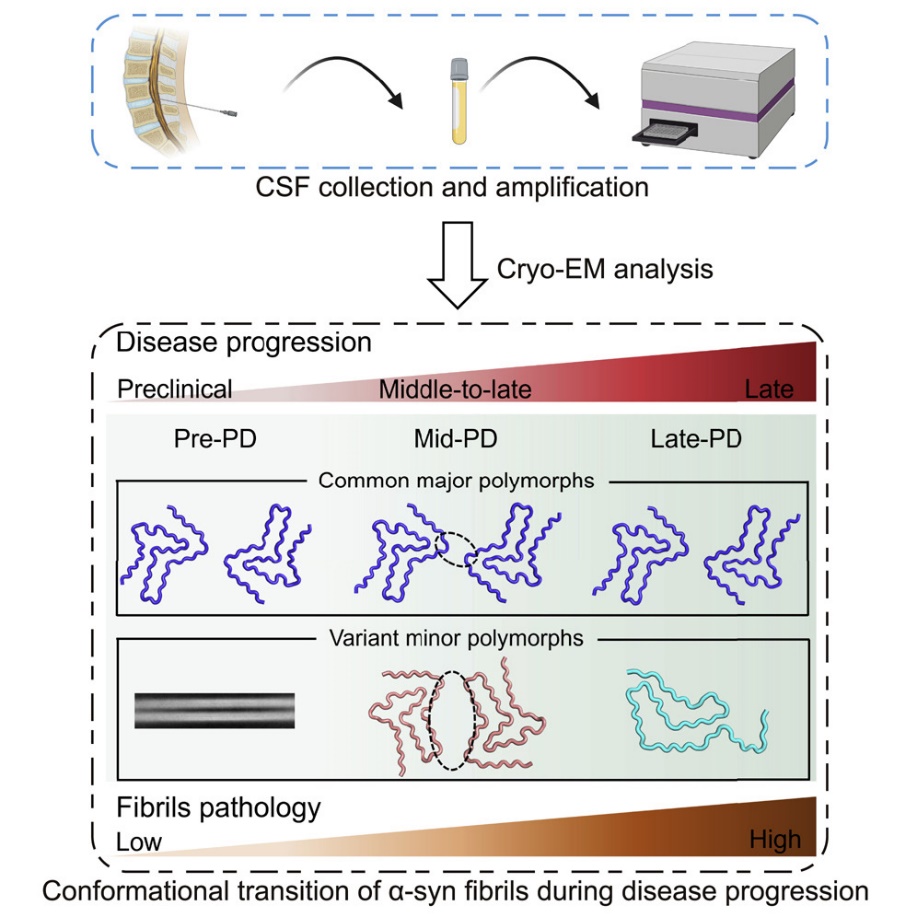
图1. 实验设计流程和技术路线
该研究采集了4例健康人、1例临床前驱期PD患者、4例临床中晚期PD患者和1例临床终末期PD患者的脑脊液(cerebrospinal fluid, CSF)样品。通过使用蛋白质聚集扩增技术,以CSF中的少量α-syn病理性纤维聚集作为模板,来诱导反应体系中的α-syn单体转化为纤维聚集体,结合ThT荧光动力学实现对CSF中的α-syn聚集体的高灵敏度检测。随后,研究者使用冷冻电镜(cryo-EM)技术解析了不同临床阶段样本扩增的α-syn淀粉样纤维产物的原子级分辨率结构(图1)。

图2. CSF样品的体外扩增实验及对应扩增产物的神经元病理表征
研究表明,不同临床阶段PD患者来源的CSF样品,在体外扩增得到的α-syn纤维具有不同的形态学特征。并且CSF扩增的α-syn纤维产物具有显著不同的诱导神经元内源α-syn病理聚集的能力。患者所处的PD临床阶段越靠近终点,其CSF样品扩增出的α-syn纤维相对应表现出越强的神经元病理(图2)。进一步通过冷冻电镜技术,发现不同临床阶段PD患者来源的α-syn纤维具有一类较大差异的构象(图3)。这种纤维结构的差异正是其产生神经元病理异质性的结构基础。
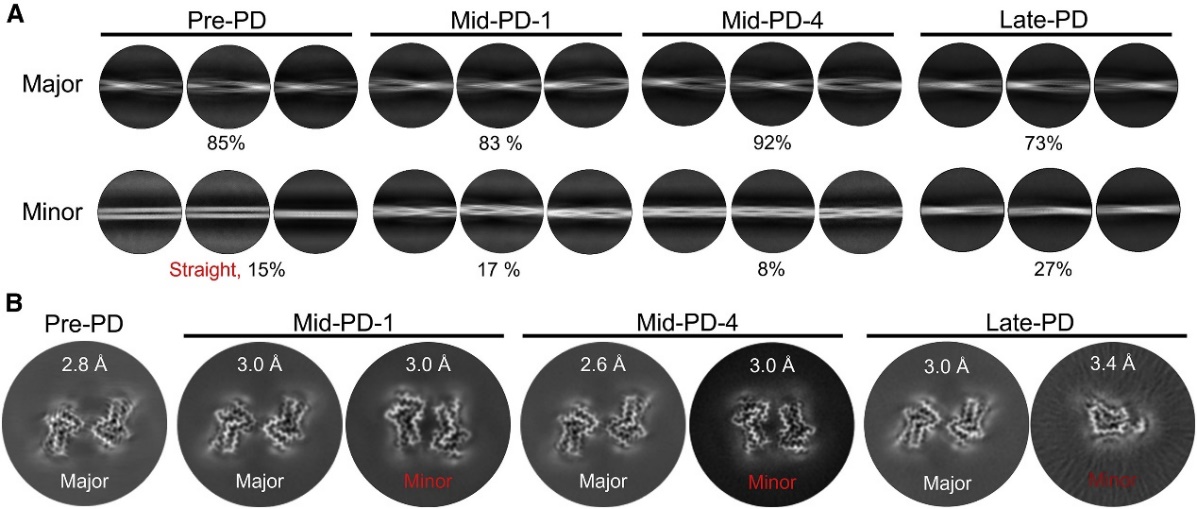
图3. 不同临床阶段PD病人来源α-syn纤维的病理毒性及冷冻电镜结构
综上,该研究工作通过结合不同PD阶段的病人CSF临床样本,体外扩增及冷冻电镜等技术,发现α-syn在PD的不同阶段能够形成不同的病理聚集体结构,阐释PD疾病不同发展阶段下的异质性细胞环境能够影响α-syn纤维构象的转化。本工作加深了人们对PD发病和发展过程在分子原子层面的理解,提供了对于PD致病机理的新认识。
这项工作得到了国家自然科学基金、上海市科委、上海市科技重大专项等项目的资助。范云博士和孙云鹏同学为文章的共同第一作者。复旦大学华山医院王坚教授和上海交通大学的李丹教授为共同通讯作者。





 交大主页
交大主页