

科研动态

融合基因是两个基因的全部或一部分序列相互融合为一个新的基因的过程,作为重要的生物标志物在癌症的早期识别和诊断中发挥关键作用。常规测序方法如RNA-seq测序等价格高且灵敏度低,而靶向功能基因的策略虽然能减少成本、提高灵敏度,但受到连接效率和低频突变富集难的限制,导致接头序列不能捕获靶向分子,产生假阴性结果。目前,针对双链DNA稳定性对连接效率的影响还没有深入研究。
另一方面,低频突变在癌症的早期识别的监督中有重要作用,但此类突变的识别和定量非常困难。基于PCR策略,已开发多种方法靶向放大低频突变,但大部分方法只适用于已知融合基因检测,对于未知的融合基因的检测和分析仍然存在挑战。
上海交通大学生物医学工程学院、张江高等研究院DNA存储研究中心宋萍课题组基于接头双链DNA杂交热力学的研究,探究了接头杂交产率对捕获分子效率的影响,开发一种ligation tail adapter sequencing 的方法用于提高融合基因的捕获效率,进而降低临床检测假阴性。该工作由研究生吴熠、郭金霄等合作完成,发表在Angewandte Chemie International Edition (e202316484)
作者提出了一种热力学调控的接头测序(Ligation Tail Adapter Sequencing, LTA-seq)方法,该方法可以实现高产量的双链杂交和目标分子的有效捕获。LTA-seq 基于DNA双链杂交热力学调控,提高了双链接头的杂交产率,探究了其对捕获效率与定量检测的影响。同时通过巢式接头PCR,增加了靶标分子的中靶率,降低了非特异性的扩增。
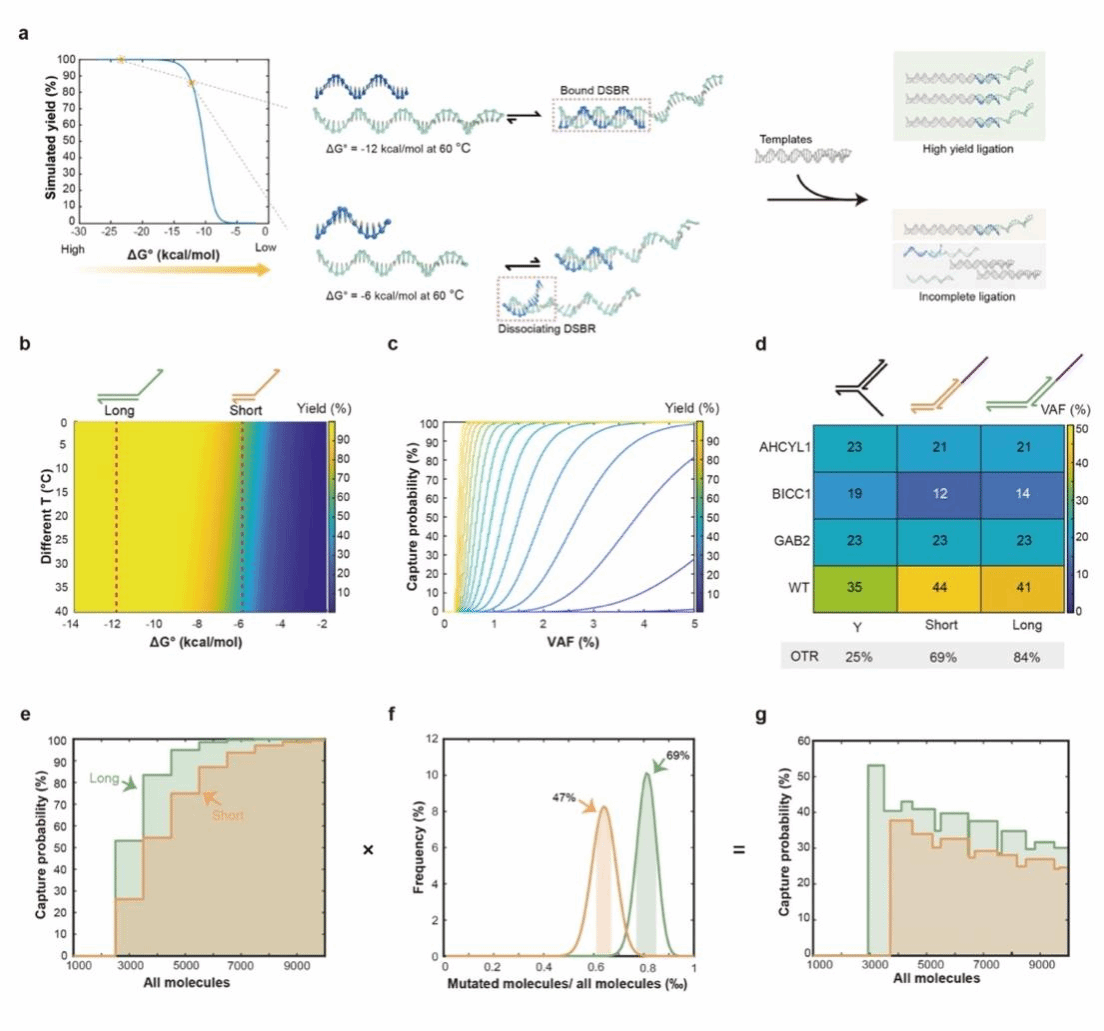
图1 利用LTA-seq进行热动力学调控的适配体连接
利用LTA-seq可以实现未知融合基因的精准检测。针对H2228 样本中的EML4-ALK融合片段,靶向ALK 内含子19进行引物设计,经过捕获、扩增、测序后在H2228样本中发现EML4的片段,而在野生型样本(NA18537)中并未发现。
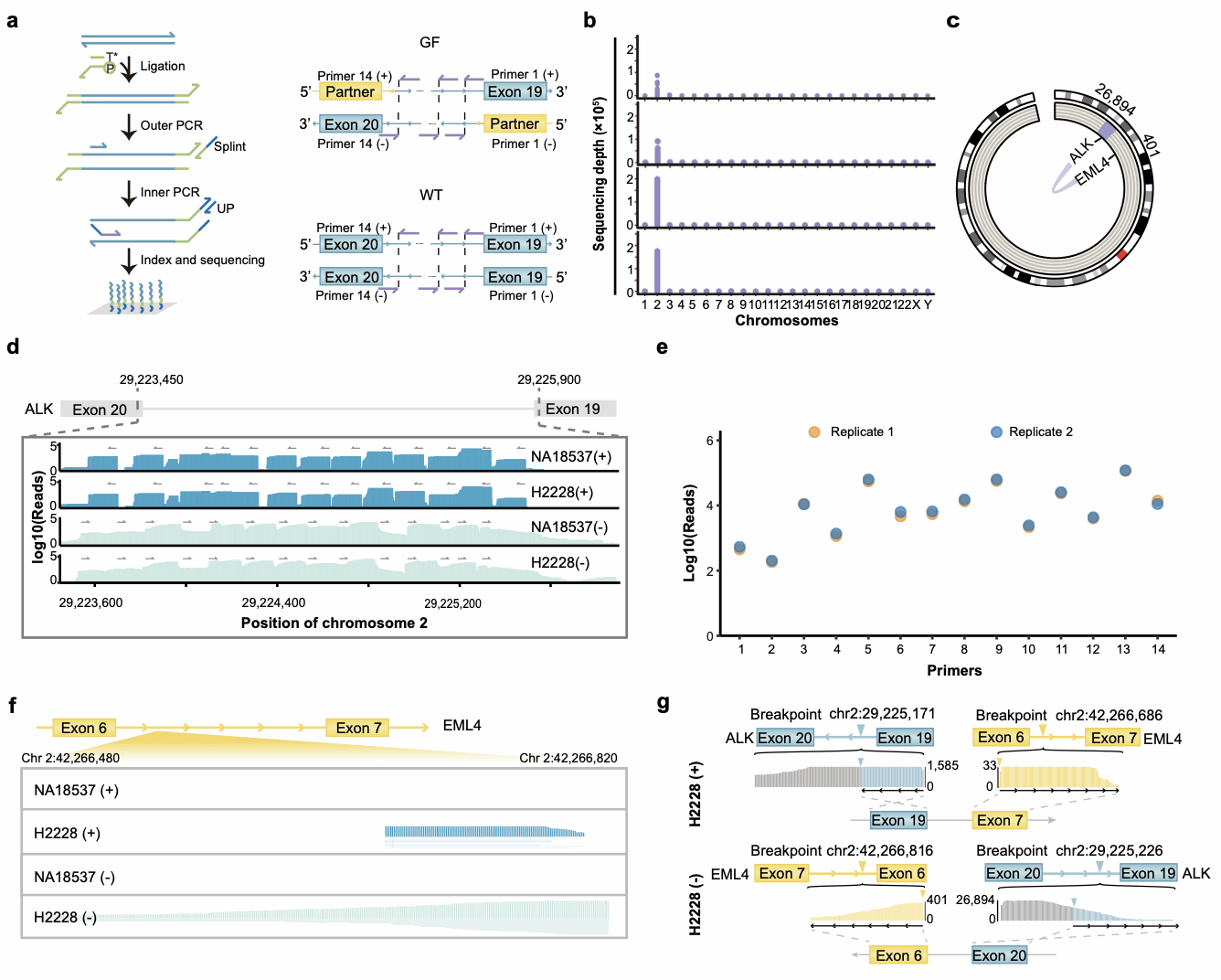
图2 LTA-seq应用于识别 H2228 细胞系中的EML4-ALK融合
针对低频融合基因,将LTA-seq与BDA技术结合开发锚定抑制探针置换扩增技术(Anchored Blocker Displacement Amplification,ABDA),利用正向引物和抑制探针之间能量差异抑制野生型扩增,从而实现突变模板的放大富集。与未使用blocker 抑制的样本检测结果相比,ABDA实现了7倍的融合基因放大,并可以在测序成本上减少至少2.4倍。
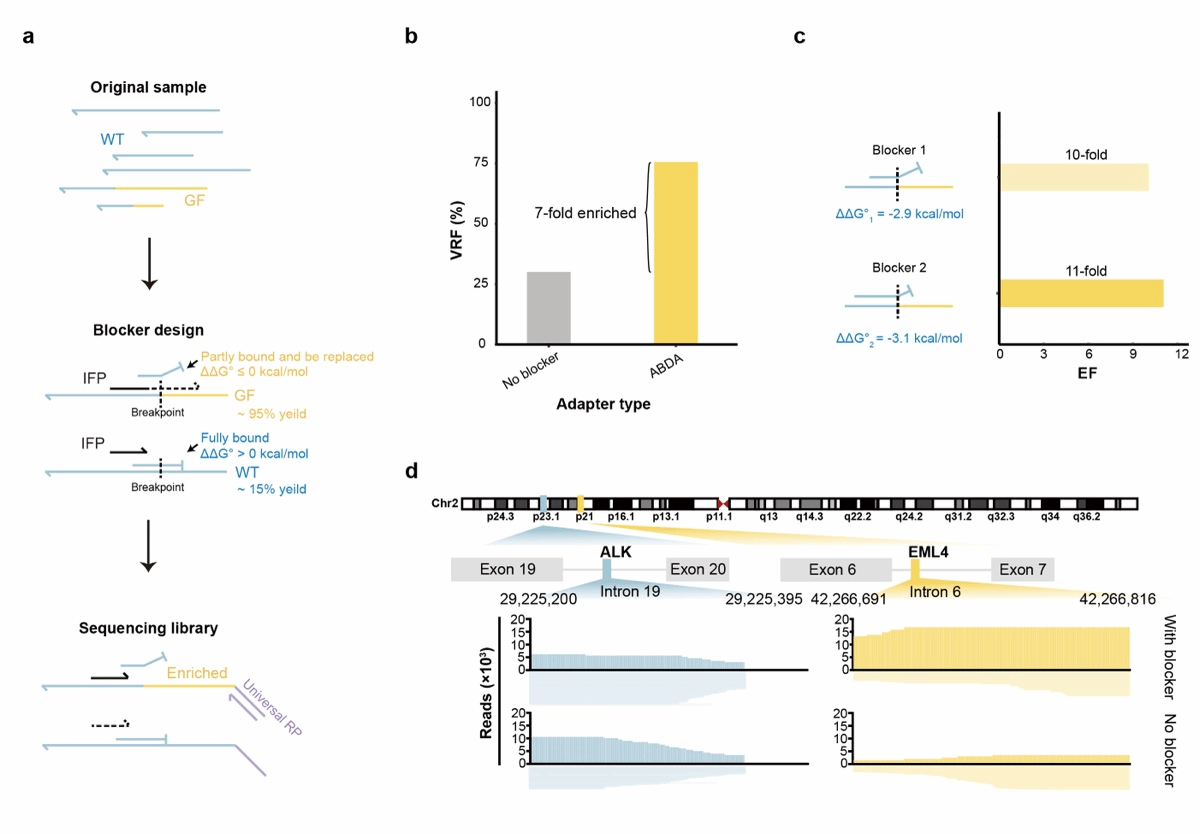
图3 LTA-seq与BDA技术结合用于融合基因的选择性富集
除了二代测序外,LTA-seq 可以与Nanopore 测序等三代技术结合,实现实时、快速的融合基因检测。与二代测序的边合成边测序不同,Nanopore测序能够实时的读取碱基序列,且不需要额外的读数拼接等操作,因此有利于快速融合基因识别。
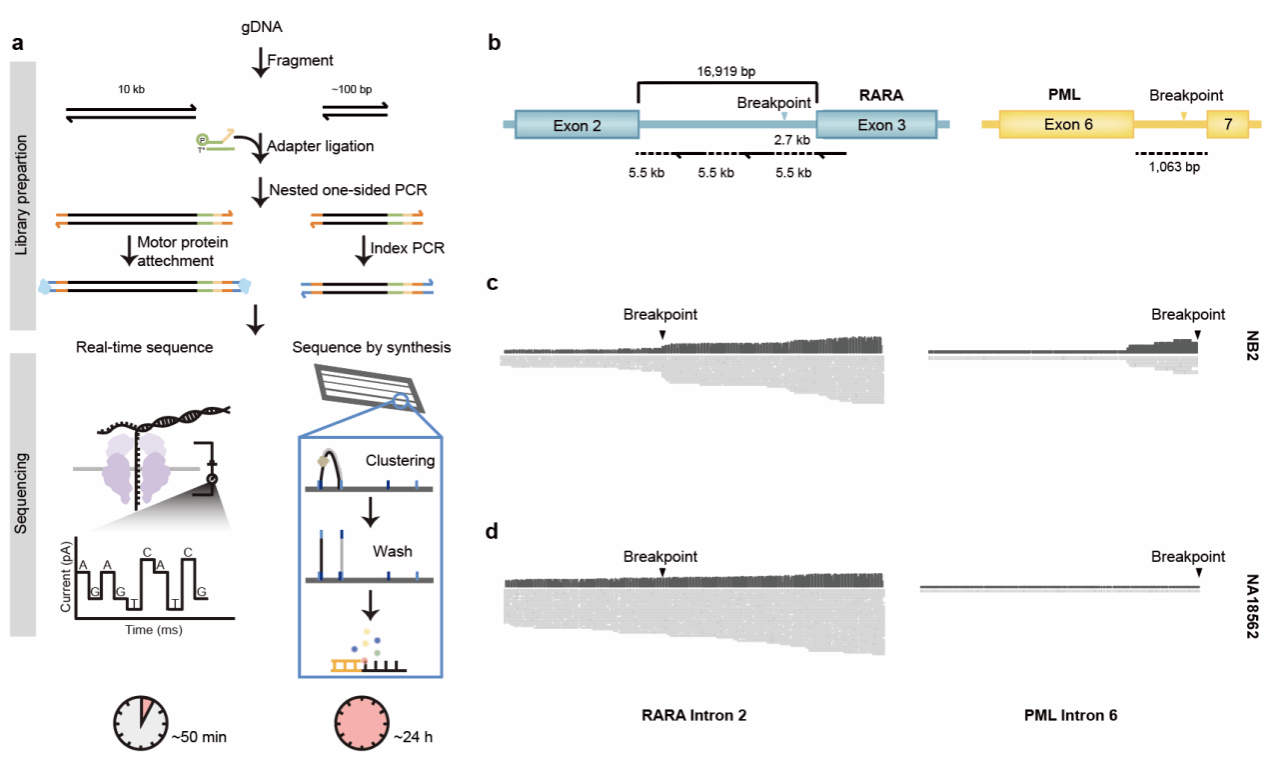
图4 LTA-seq结合Nanopore 测序方法检测RARA-PML融合基因
本研究中,LTA-seq基于双链杂交产率,提高接头法在分子捕获中的效率,并通过与BDA技术结合实现低频突变的富集放大,在提高检测准确度的同时,有效减少测序成本与分析数据量,实现标志物的快速识别。





 交大主页
交大主页