

科研动态

轴手性羰基化合物不仅广泛存在于天然产物、生物活性分子、药物和材料中,也是一类具有优势结构的手性配体或有机催化剂,在不对称催化中具有广阔的应用前景。但是这类结构的合成往往需要繁琐的步骤,一定程度上限制了它们的进一步发展。尽管近年来不对称催化合成轴手性化合物的方法取得了显著进展,但通过不对称羰基化反应直接合成轴手性羰基化合物仍需进一步探索。
催化羰基化反应是合成羰基化合物最直接高效的方法,自19世纪30年代首次实现以来,羰基化已经成为均相催化领域工业应用规模最大的反应,通过该技术每年生产超过千万吨大宗和精细化学品。相比之下,不对称羰基化反应的发展则相对滞后,主要存在以下挑战:(1)高压CO与手性配体竞争配位,削弱了配体的手性控制能力;(2)酰基金属物种的转化能垒高,且往往是反应的决速步,需要较高的温度;(3)产生的手性羰基化合物在反应体系中易消旋化。尽管如此,在过去的几十年里仍有许多不对称羰基化反应被开发出来,但底物范围大多局限于降冰片烯、苯乙烯、环丙烯等活化的烯烃,且反应主要用于构筑具有中心手性的羰基化合物,利用不对称羰基化反应合成轴手性羰基化合物的方法仍有待开发。
近日,上海交通大学变革性分子前沿科学中心长聘教轨副教授、张江高等研究院入驻科学家刘家旺课题组,利用手性钯催化剂,通过底物动态动力学不对称转化的策略,发展了外消旋联杂芳基三氟甲磺酸酯与CO以及胺类亲核试剂的不对称胺羰化反应,实现了轴手性酰胺的高效、高对映选择性合成。详细的机理研究表明:酰胺产物的杂环氮原子与NH结构之间的分子内氢键作用会加速产物的轴旋转,从而导致产物的对映选择性显著下降,而碳酸铯的使用破坏了这种分子内氢键,是反应取得高对映选择性的关键。此外,合成的部分酰胺产物可以直接作为手性三齿配体应用到铜催化的不对称自由基反应中,展示了其作为手性配体的应用潜力。

图1 轴手性羰基化合物的用途和反应设计
作者以消旋的联杂芳基三氟甲磺酸酯化合物1a和对甲基苯胺2a作为模板底物,以Pd(OAc)2作为催化剂,(S, S)-BenzP (L1) 为手性配体,碳酸铯作碱,二氯甲烷和1,2-二氯乙烷作为反应溶剂,在10 个大气压CO氛围下80 ℃反应18小时,即可以87%的分离产率以及94% 的ee值得到轴手性酰胺产物。
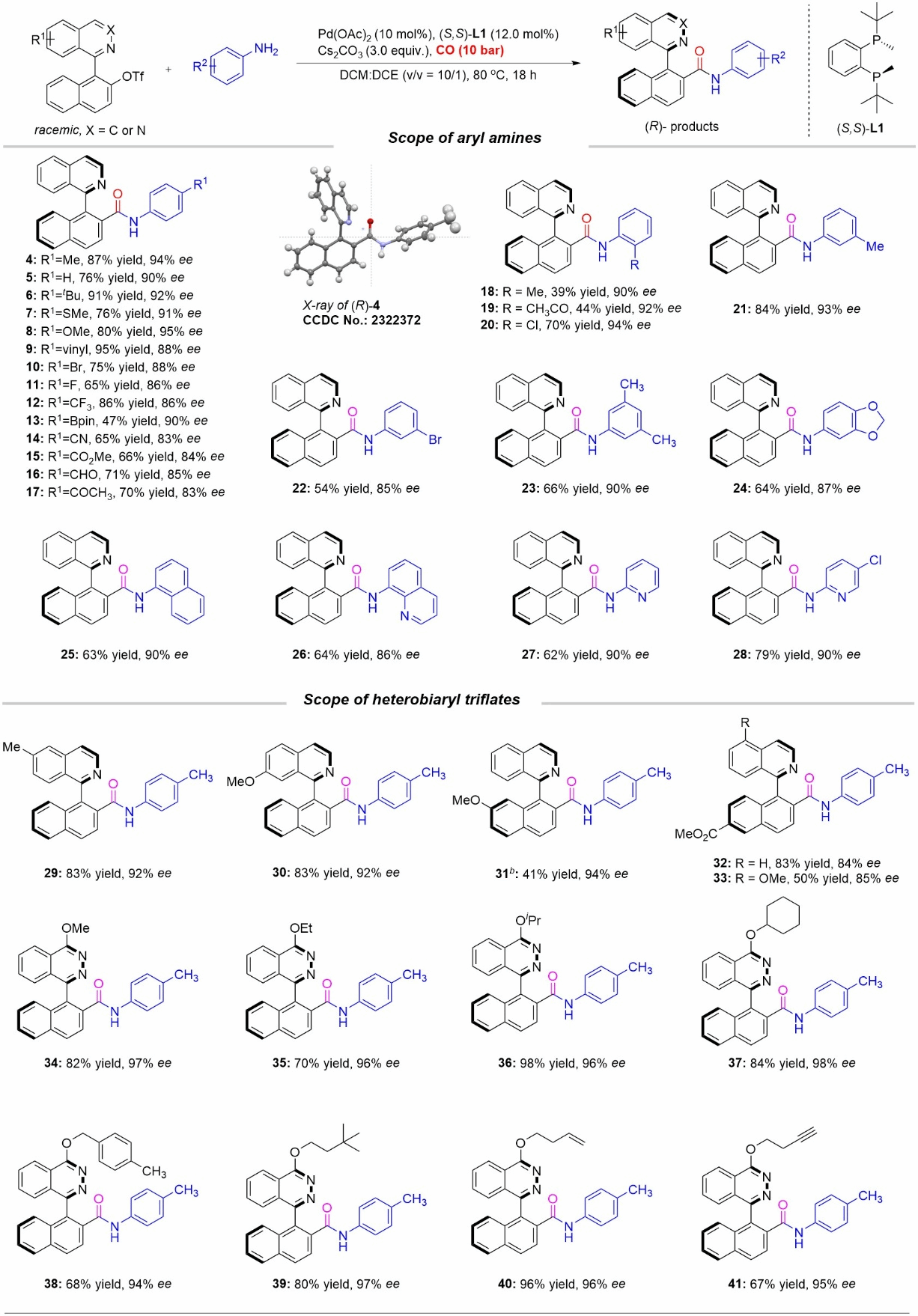
图2芳香胺和联杂芳基三氟甲磺酸酯底物范围
在最优反应条件下,作者首先对芳香胺底物适用范围进行了考察(图2),一系列苯环上带有缺电子和富电子取代基的芳香胺,都能通过高效的动态动力学不对称胺羰基化过程,得到轴手性酰胺。随后,作者对联杂芳基三氟甲磺酸酯底物进行了考察(图2),反应仍具有较好的普适性,以良好到优秀的产率以及优秀的对映选择性得到手性酰胺产物。
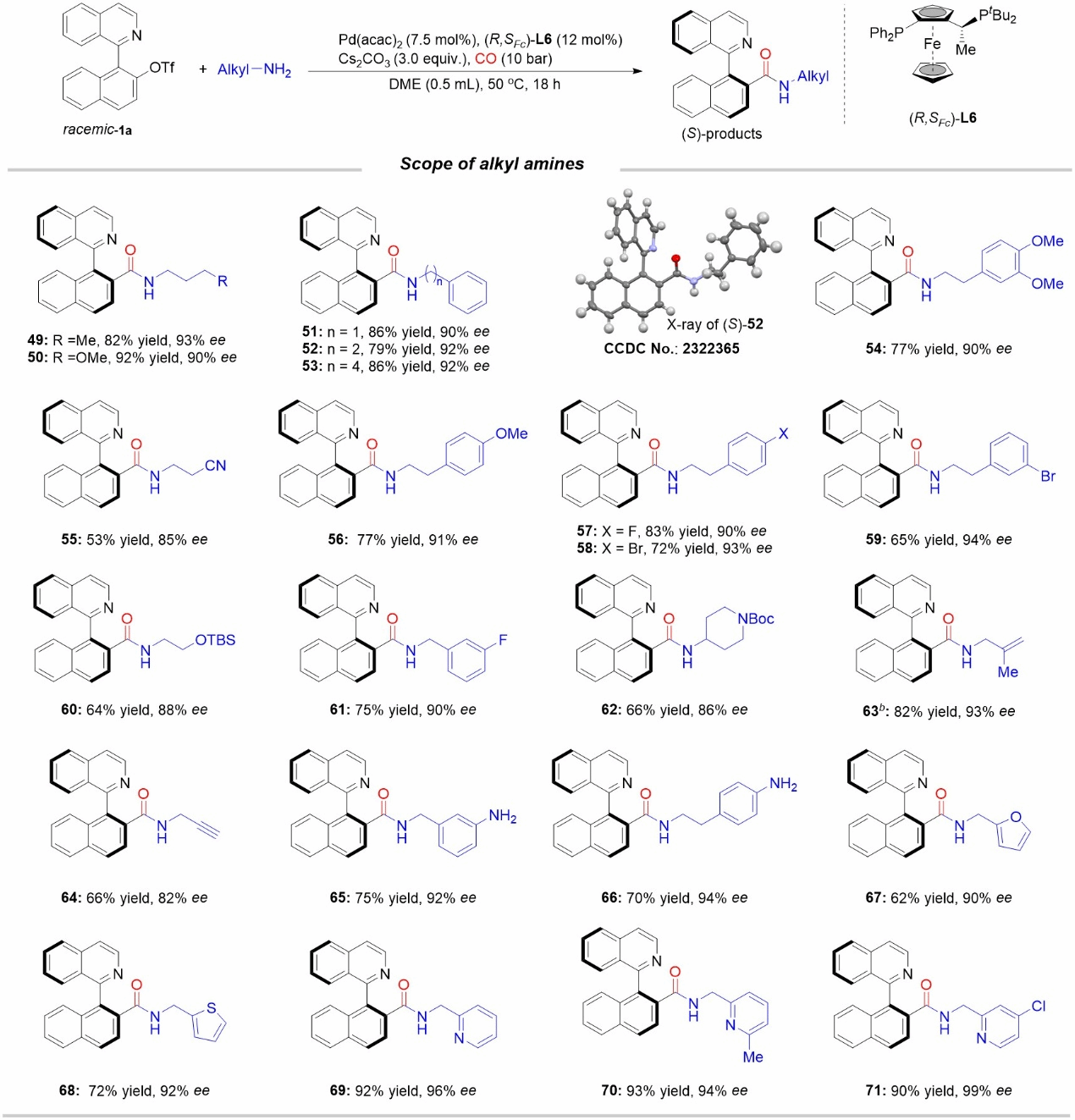
图3烷基胺底物范围
作者接下来研究了使用亲核性更强的烷基胺化合物作为亲核试剂,烷基胺可能会加速对酰基钯物种的进攻,从而对反应的对映体选择性产生不利影响。通过优化手性配体等条件,作者得到了一套适用于烷基胺的不对称羰基化反应条件,并对相应的底物适用性进行了系统考察,各类烷基伯胺都具有良好的兼容性,得到相应轴手性酰胺。
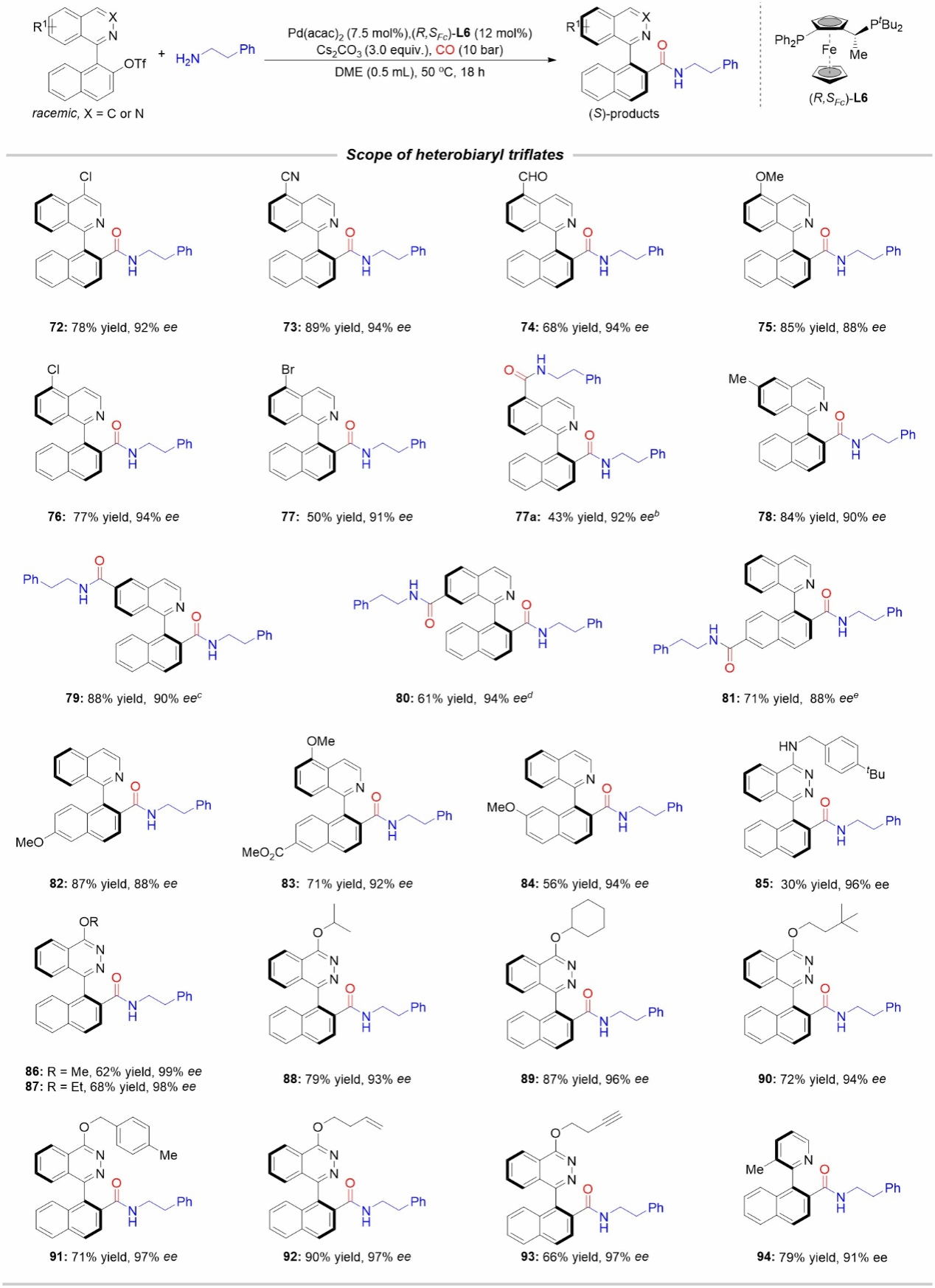
图4联杂芳基三氟甲磺酸酯底物范围
接下来作者以2-苯乙胺作为偶联试剂,对联杂芳基三氟甲磺酸酯的适用范围进行了研究。如图4所示,在异喹啉环的4-6号位上含有Me、Cl、CHO、CN和OMe取代基的底物耐受性良好。值得注意的是,当底物中异喹啉环或者萘环上含有溴原子取代基时,会发生两次胺羰基化反应。其他取代基和官能团在该体系下均能兼容,得到相应的手性酰胺产物。
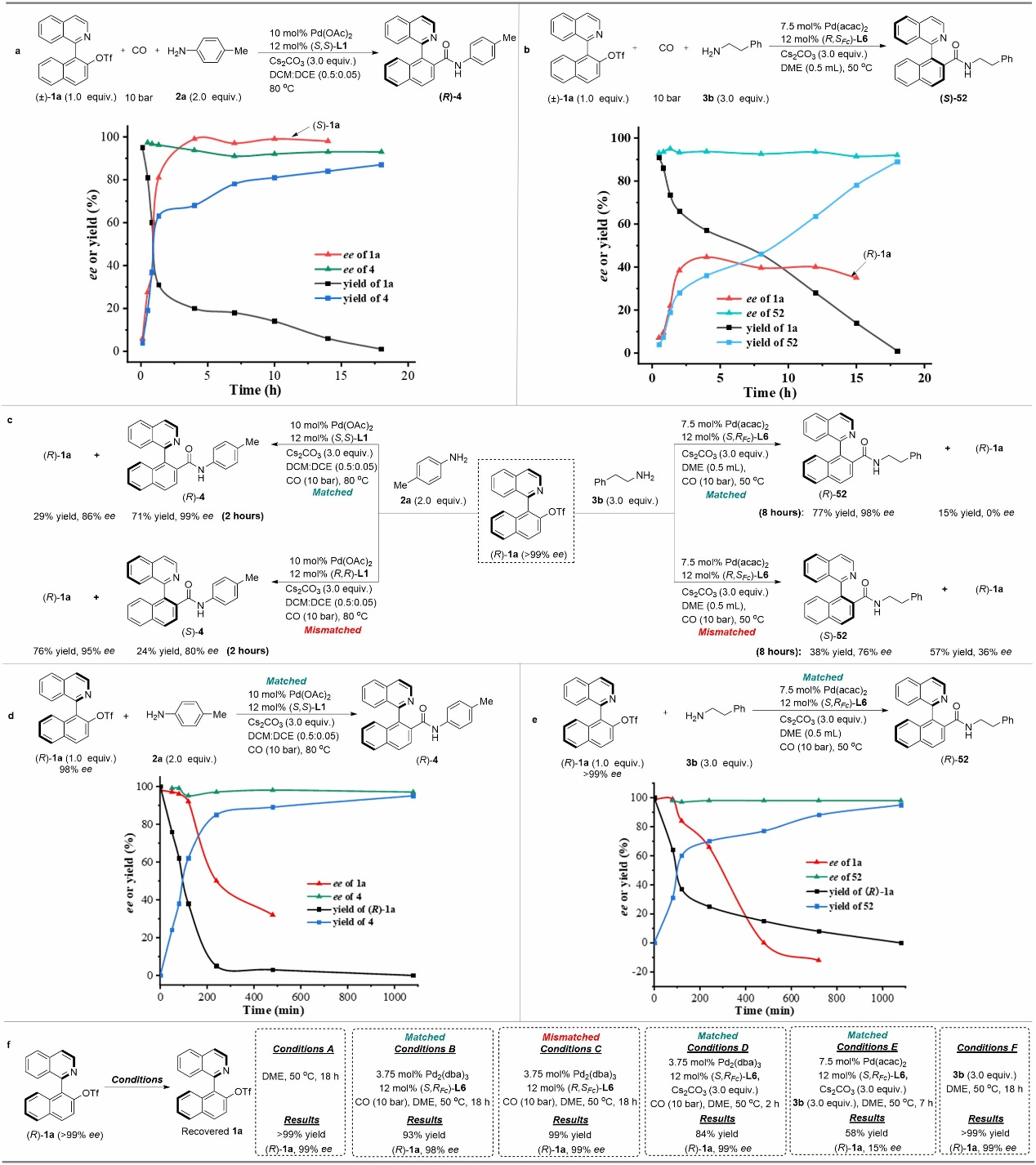
图5 机理研究
为深入了解动态动力学不对称胺羰化反应过程,作者通过动力学实验以及控制实验,对反应中涉及的不同构型底物相互转化以及手性催化剂对底物识别等过程进行了详细的研究。实验表明:在标准反应条件下,不同构型的底物之间可以通过可逆的氧化加成-差向异构化-还原消除过程进行相互转化。
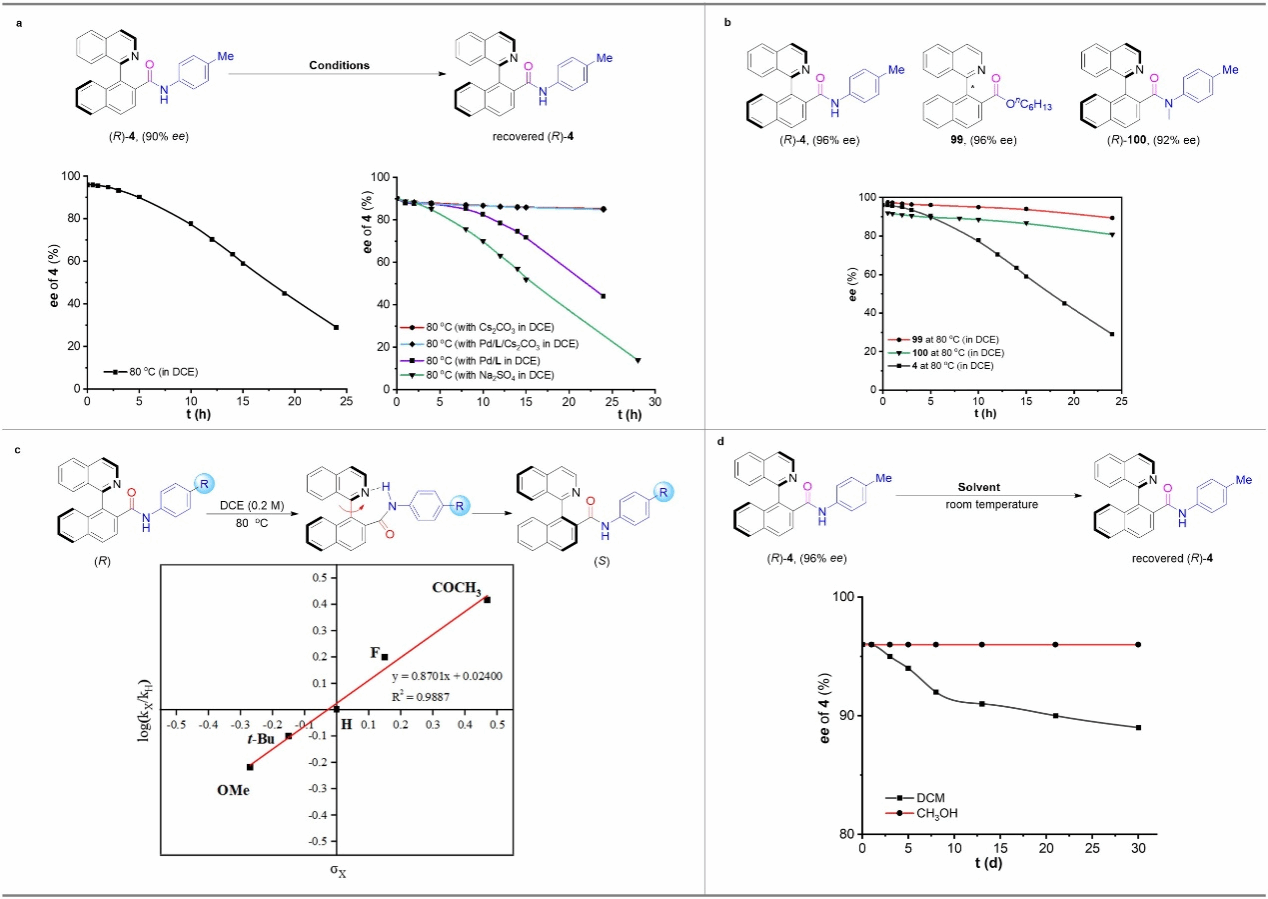
图6 手性轴的稳定性研究
在测定轴手性酰胺(R)-4的旋转能垒时,作者注意到(R)-4的对映选择性在24小时内从96%迅速下降到29%,这与催化反应中获得的高ee值相矛盾。为此,作者通过添加不同的反应物进行了动力学取样实验,结果表明碱在稳定产物4的构型中起关键作用。为进一步探究碱是如何抑制产物4的消旋过程,作者做了对比实验。将结构相似的轴手性酯99进行同样的动力学取样实验,发现与酰胺4相比,酯99的消旋速率要慢,由于酯基中碳原子的亲电性更强,因此排除了通过文献报道的两性离子过渡态消旋的途径。同时,作者还发现在使用甲基化的酰胺化合物 (R)-100时,也观察到其消旋过程显著减慢,这意味着酰胺产物的NH基团可能与外消旋相关。根据文献报道,作者推测酰胺的NH基团与异喹啉环的氮原子之间的分子内氢键可能加速轴的旋转,从而导致产物消旋。为了获得更多的证据,作者结合Hammet曲线来研究芳环取代基对消旋速率的影响。实验结果表明芳胺苯环上带有吸电子取代基的轴手性酰胺消旋速度更快,这是因为吸电子芳胺中的NH基团与异喹啉氮原子之间的氢键更强。此外,作者将(R)-4 (96% ee) 的甲醇或二氯甲烷溶液在室温下放置30天,发现二氯甲烷中产物ee降至89%,而在甲醇中未观察到ee值降低,这表明分子内氢键很可能被质子溶剂甲醇破坏。基于以上实验结果和文献报道,作者提出分子内氢键会加速酰胺产物的手性轴旋转,而碱的加入会破坏分子内氢键的形成,从而抑制产物的消旋过程,这是反应取得高对映选择性的关键。

图7 合成应用
最后,作者将反应体系扩大,同样以优秀的收率和选择性得到相应的产物(S)-69,该产物无需进一步修饰可以直接作为手性钳形NNN配体(图7a)。初步结果表明该类化合物在铜催化的几个自由基不对称反应中具有一定的手性诱导能力,展示了其作为手性配体的潜力。
总之,刘家旺课题组开发了一种高效的钯催化动态动力学不对称胺羰化反应体系,实现了CO参与的轴手性酰胺合成,反应具有对映选择性高、底物范围广以及官能团耐受性好等优点。机理研究表明,酰胺产物的分子内氢键作用会导致产物的消旋,而碱的加入破坏了分子内氢键,这是反应取得高对映选择性的关键。该反应不仅为轴手性酰胺的合成提供了简洁的路线,同时也为不对称羰基化反应的发展以及手性三齿配体的合成提供了新方法。
该研究工作近期以Enantioconvergent synthesis of axially chiral amides enabled by Pd-catalyzed dynamic kinetic asymmetric aminocarbonylation为题发表在Nature Communications上,文章通讯作者为上海交通大学刘家旺副教授,第一作者为上海交通大学博士研究生苏雷。该项工作得到了科技部重点研发计划、国家自然科学基金、中央高校基本科研业务费和上海市启明星计划资助。
文章链接:https://www.nature.com/articles/s41467-024-51717-8





 交大主页
交大主页