

科研动态

近日,国际权威期刊《Proceedings of the National Academy of Sciences》在线发表了我校生命科学技术学院、张江高等研究院瞿旭东课题组与武汉大学张郑宇课题组、厦门大学王斌举课题组的合作成果,题为“A nucleobase-driven P450 peroxidase system enables regio- and stereo-specific formation of C‒C and C‒N bonds”。本文的共同第一作者为生命学院博士后魏广证、武汉大学博士生段博瑞和厦门大学博士生周太平;共同通讯作者包括瞿旭东教授、张郑宇教授和王斌举教授。
细胞色素P450酶被誉为“万能生物催化剂”,在药物代谢、合成及生物制造中发挥着重要作用。传统上,P450酶需要氧气,并将其转化为活性物种Compound I(CpdI),之后再进行加氧反应(如羟化、环氧化等),或通过自由基驱动的C-C/C-X键形成与断裂反应(如偶联、断裂和重排等)。然而,P450酶在活化氧气时常需使用昂贵的辅因子(如NADPH)及复杂的电子传递辅助蛋白,这限制了其实际应用。部分P450酶因能利用廉价的H₂O₂形成CpdI而受到关注,但大多数只能催化简单的加氧反应(称为P450 peroxygenases,过加氧酶),而催化单电子氧化生成自由基无加氧过程的P450 peroxidase (P450过氧化物酶)则相对罕见,该类活性通常催化化合物骨架C-C/C-N键的形成(图1A)。尽管已有方法将普通P450酶改造成P450过氧化物酶,但成功案例少,且催化的多为简单反应。这主要归因于P450过氧化物酶的活性尚未被充分挖掘,以及对其催化机制的理解不足。因此,深入探索天然P450过氧化物酶的催化机制,将有助于开发更具前景的酶促反应体系。
在前期研究中,瞿旭东课题组发现了首个能催化含色氨酸二酮哌嗪(TDKP,图1B)二聚化形成吡咯并吲哚生物碱的P450酶(Nat Commun 2018, 9, 4428),并阐明了其独特的催化机制(Nat Commun 2020, 11, 6251),从而大幅度拓展了此类P450酶的底物谱,实现了上百个活性吡咯并吲哚生物碱的生物合成(Angew Chem Int Ed 2023, 62, e202304994),并提出了此类生物碱的新分类方法(Nat Prod Rep, 2022, 39, 1721)。
在本研究中,研究团队采用进化关系导向的基因组挖掘策略,从细菌中鉴定出一种新的P450酶(PtmB)。该酶能够催化三种天然的嘌呤核碱基(鸟嘌呤、次黄嘌呤和腺嘌呤)与TDKP发生异源二聚化反应,生成独特的C3-核碱基吡咯并吲哚及核碱基-TDKP二聚体生物碱。与依赖于NAD(P)H辅因子及电子转移系统的典型TDKP二聚化P450合成酶不同,PtmB及其同源蛋白能够利用H₂O₂催化腺嘌呤及其他带有6-氨基的嘌呤核碱基与TDKP反应,展现出罕见的过氧化物酶活性。
通过对多个PtmB-底物复合物的晶体结构解析、定点突变分析和QM/MM计算,研究团队深入揭示了PtmB独特的催化机制,发现腺嘌呤在PtmB过氧化物酶活性中的独特双重功能:既作为反应的底物,又作为酸碱催化剂激活H₂O₂转化为催化中间体Cpd I。进一步的底物类似物活性测试、定点突变以及分子动力学模拟结果表明,腺嘌呤6位上的NH₂取代基通过参与广泛的氢键网络(图1D),对形成有利于H₂O₂活化的核碱基构象至关重要。分子动力学模拟还表明,环二肽TDKP具有灵活的构象转变,这进一步促进了C-C和C-N键形成吡咯并吲哚结构的立体和区位选择性合成。
该项研究揭示了首个以底物-核碱基驱动的P450过氧化物酶催化体系,并且是已知能够催化的最复杂化学反应的P450过氧化物酶,能够立体和区位选择性构建C-C和C-N键,合成复杂天然产物骨架。核碱基作为DNA和RNA的基础单元,同时在部分核酶(RNA)的功能中充当关键酸碱催化子,本研究创新性地发现了核碱基在P450过氧化物酶催化中作为酸碱催化剂的新功能。这一发现有望为新型P450过氧化物酶及基于核碱基的生物催化剂的开发奠定重要基础。
该研究工作得到了国家自然科学基金面上项目、青年项目以及博士后面上基金的支持。
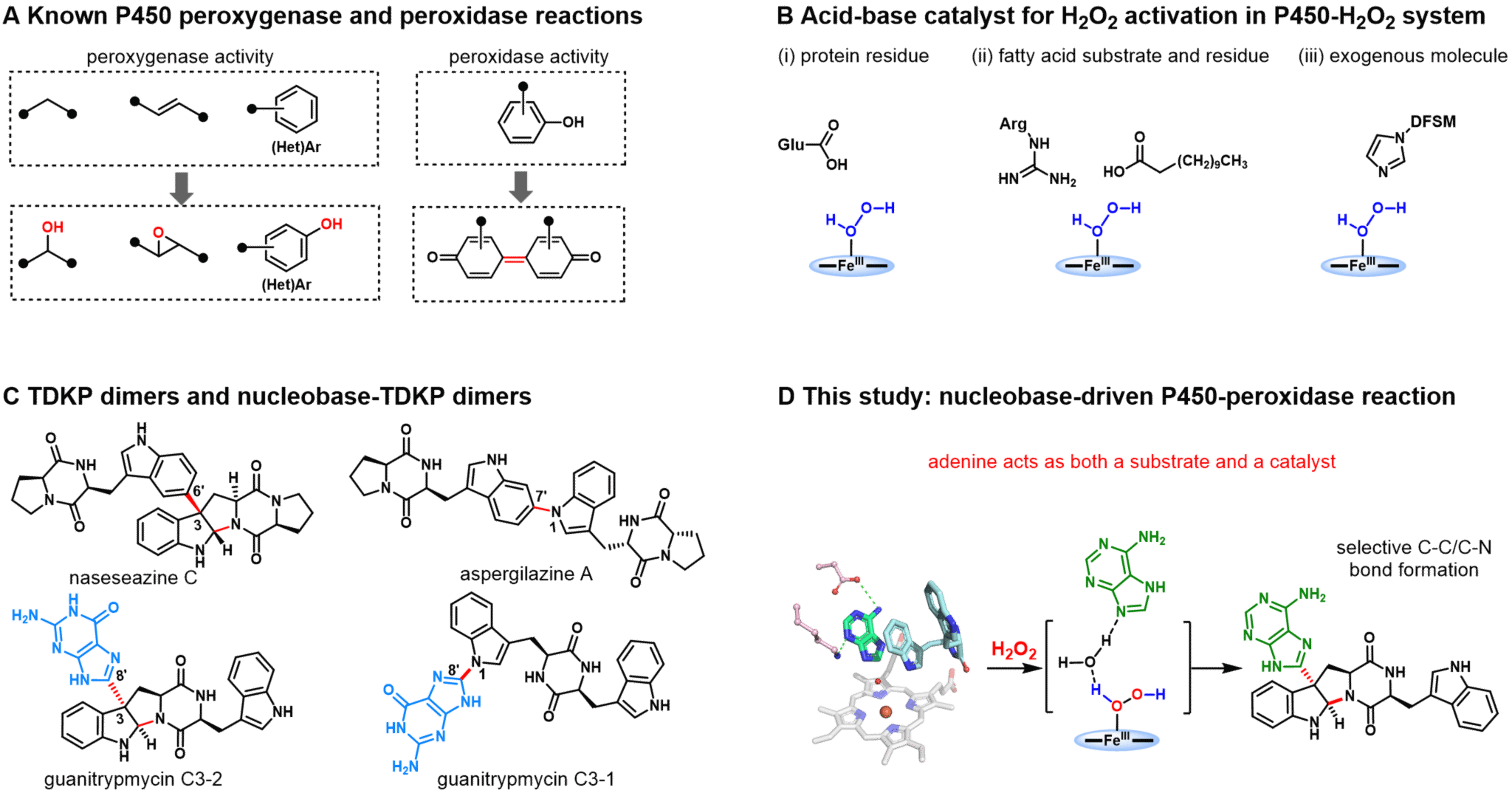
图 1. P450-H2O2活性及其机制。(A)典型的 P450 过加氧酶和过氧化物酶的活性比较。(B)P450 过加氧酶和过氧化物酶中活化H2O2的酸碱催化机制。(C)一些代表性的TDKP二聚体及TDKP核碱基二聚体天然产物。(D)本研究发现的核碱基催化机制。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2412890121





 交大主页
交大主页