

科研动态

近日,Nature Communications在线发表了上海交通大学张江高等研究院未来材料创制中心李万万研究员、于绪江副教授团队的“A high-valence bismuth(V) nanoplatform triggers cancer cell death and anti-tumor immune responses with exogenous excitation-free endogenous H2O2- and O2-independent ROS generation”研究论文,报道了一种五价铋纳米材料(NaBiVO3-PEG)。这一纳米材料既不依赖外源性激发源,也无不依赖肿瘤内源性H2O2和O2,同时具备肿瘤微环境pH响应的自发释放活性氧(ROS)行为,进而可引起肿瘤细胞免疫原性死亡(ICD)和抗肿瘤免疫反应。论文同时得到编辑高度认可,被邀请在Nature Portfolio Communities的“Behind the Paper”栏目撰稿分享研究经历。
大多数实体瘤具有高度复杂的肿瘤免疫抑制微环境,且促炎性免疫细胞含量较低,这极大地限制了免疫治疗的临床应用。ROS不仅可以通过损伤脂质、蛋白质和DNA直接导致肿瘤细胞凋亡和坏死,还可以通过诱导免疫原性细胞死亡引发免疫反应。然而,尽管放疗(RT)、光动力疗法(PDT)和化学动力学疗法(CDT)等各种技术均可以有效调控ROS产率,但对外源性X射线或激光以及内源性H2O2或O2的依赖性一定程度上限制了高效便捷的ROS生成调控方式及应用效果,进而不利于肿瘤的有效治疗。寻找较少或不依赖外源性刺激及内源性H2O2和O2含量依赖的策略是当前领域研究的热点。
研究团队证明使用五价Bi(V)基纳米材料可以有效解决这个问题(图1)。当纳米材料被细胞内吞后,铋酸钠纳米材料能够持续发生H+加速的水解过程,通过电子转移介导的BiV到BiIII的转化和晶格氧的释放产生大量•OH和1O2,从而发挥有效肿瘤免疫治疗。
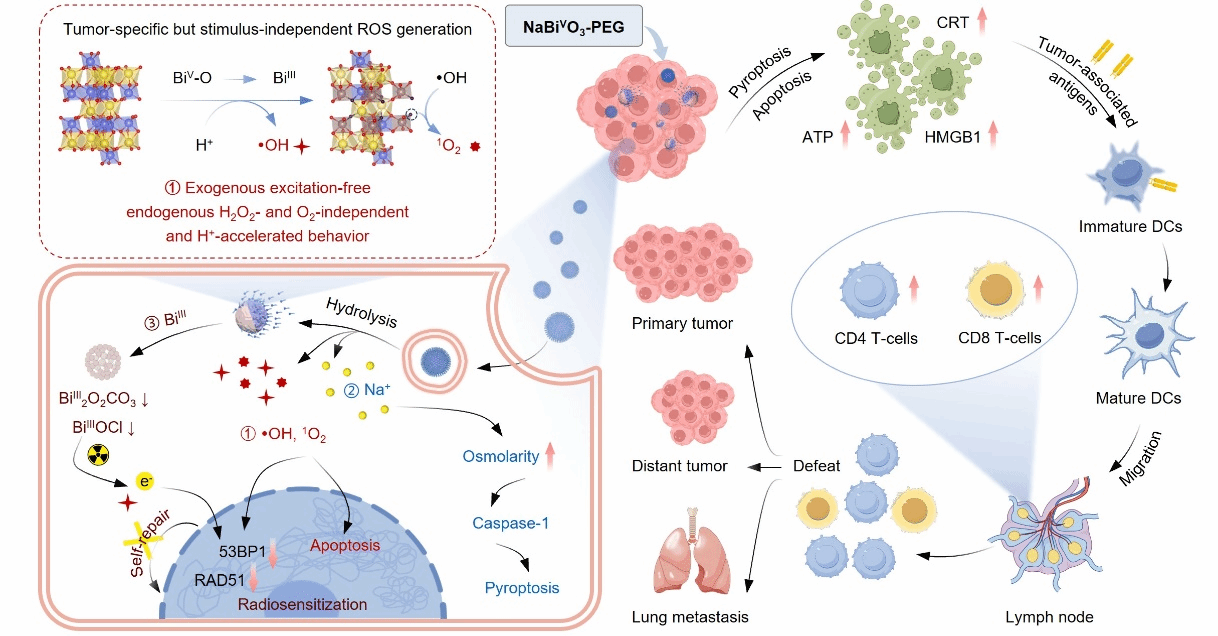
图1. NaBiVO3-PEG被肿瘤细胞内吞后在酸性条件下以无外源性刺激的方式释放•OH和1O2用于肿瘤免疫治疗的示意图。
研究提出了采用模板法以BiIIIOx纳米颗粒为模板刻蚀制备了具有均匀多孔球形纳米花状结构的五价铋(V)纳米材料(NaBiVO3-PEG),并采用聚乙二醇(PEG)磷脂衍生物进行表面修饰提高水溶液分散性(图2a和b)。所得NaBiVO3-PEG在中性条件下表现出低的水解特性和ROS生成能力,而在模拟肿瘤微环境或肿瘤细胞内的酸性缓冲液(pH 6.5~5.5)中表现出高反应活性,加速自发水解过程,并通过电子转移介导的BiV到BiIII的转化产生大量的•OH和1O2,该过程并不消耗环境中氧气(图2c-f)。此外[BiO6]八面体晶格随着BiV到BiIII的转化反应被破坏,从而释放出配位的钠离子(图2g),并且内源性的H2O2还会进一步提高1O2生成速率(图2h)。该工作系统论证了五价铋(V)材料水解行为和在无外源以及内源刺激下的ROS生成反应过程,这一点尚未被报道过。
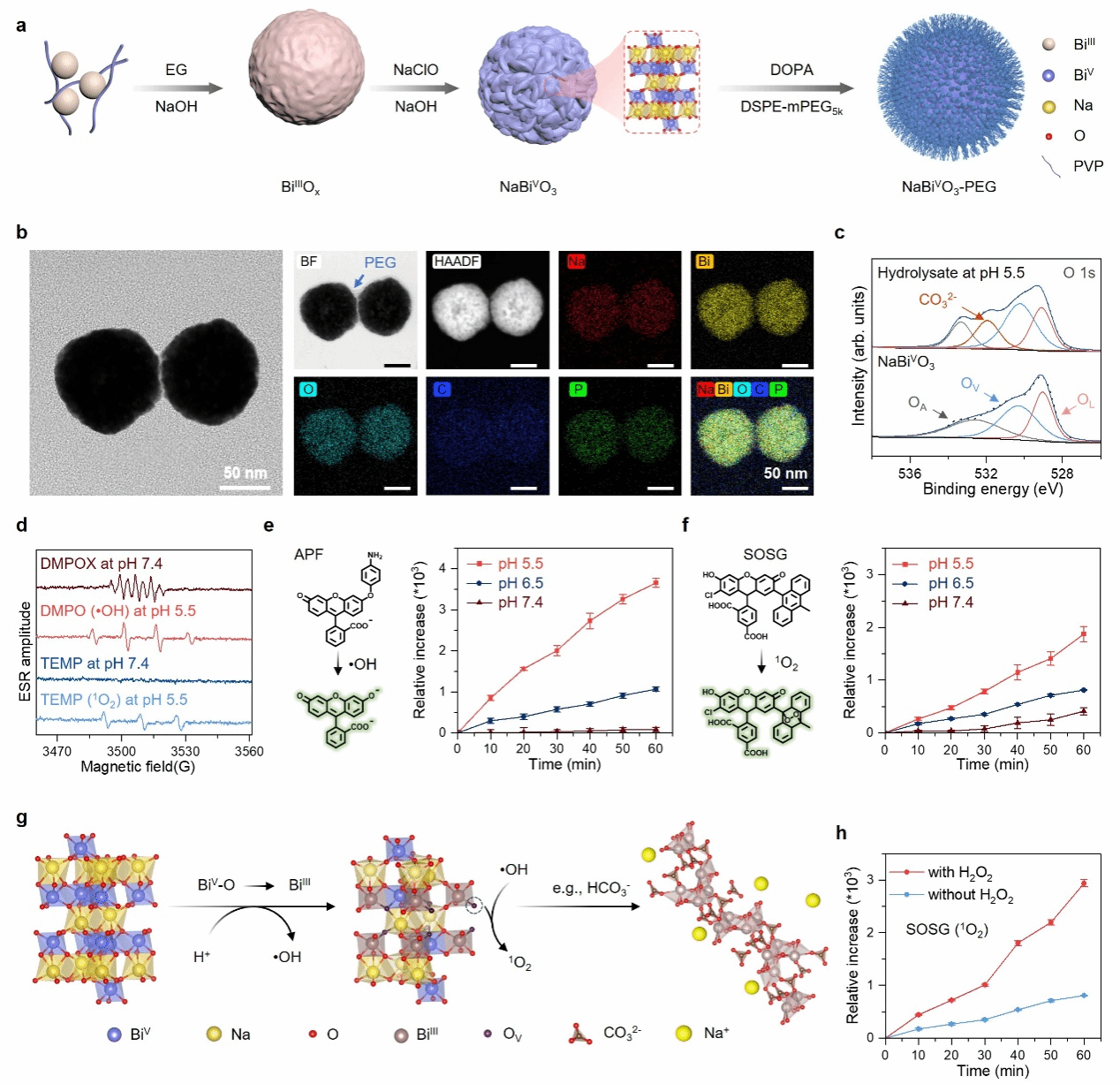
图2. NaBiVO3-PEG的制备与表征:(a)制备示意图;(b)TEM和元素mapping图;(c)在SBF(pH 5. 5)中分散0和48小时后的O 1 s高分辨率XPS光谱(OA吸附氧、OV氧空位、OL晶格氧);(d)EPR光谱;(e,f)•OH和1O2不同条件下的释放量;(g)ROS形成机理示意图;(h)有无H2O2 (1 mM)时,1O2的释放量。
受NaBiVO3-PEG在肿瘤环境中特异性产生ROS的启发,研究采用了4T1细胞双侧瘤小鼠模型和肺转移小鼠模型,验证了NaBiVO3-PEG在癌症治疗中的免疫治疗以及免疫记忆机制(图3)。肿瘤内给药后,NaBiVO3-PEG可有效抑制原发性肿瘤并通过激活免疫系统,提高肿瘤部位的CD4+T辅助细胞和CD8+细胞毒性T细胞的浸润比例,同时结合Anti-CTLA4免疫效应,能够有效治疗远端肿瘤,并形成免疫记忆,抑制肿瘤的转移。
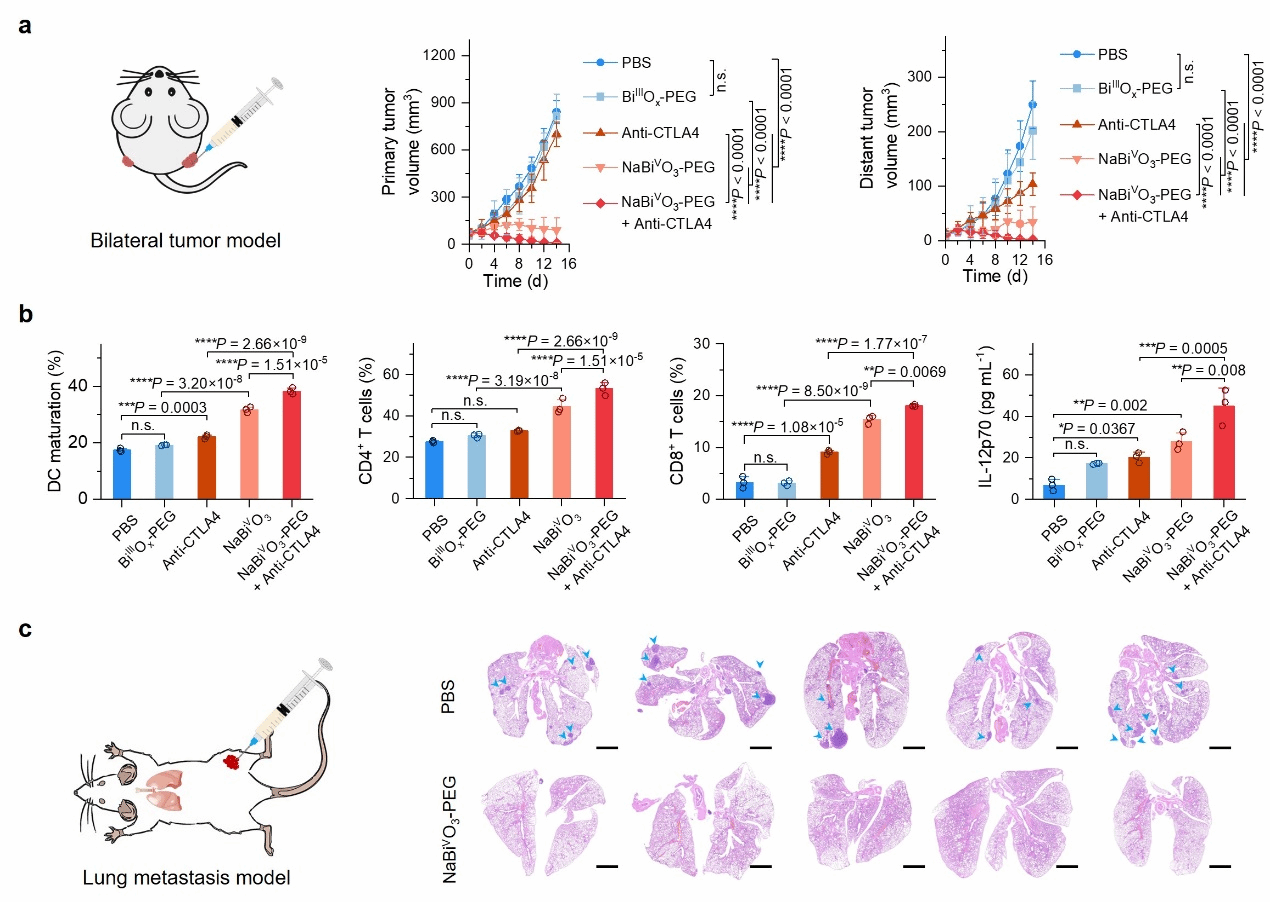
图3. NaBiVO3-PEG的体内抗肿瘤治疗效果及相应的免疫反应。(a)双侧瘤小鼠模型的构建以及治疗效果;(b)免疫反应分析和远端肿瘤免疫细胞浸润;(c)肺转移小鼠模型构建以及治疗效果。
总的来说,研究团队报道并揭示了用于癌症治疗的高价态Bi(V)纳米材料的氧化还原特性(BiIII→BiV→BiIII),这一特点在以前以Bi基纳米材料等研究工作中从未被报道。与此同时,在有机金属和有机化学中也有相关工作涉及Bi(V)的催化应用研究。因此,本工作对五价铋纳米材料的设计调控及系统机理研究启发更多Bi(V)的材料设计与引用,并为基于高价态Bi(V)的纳米药物实现肿瘤特异性释放ROS提供一个高效可行的范例。
上海交通大学材料科学与工程学院博士生唐奕章为论文的唯一第一作者,上海交通大学材料科学与工程学院/张江高等研究院李万万研究员、材料科学与工程学院于绪江副教授为论文的共同通讯作者。该研究得到了国家自然科学基金(82372089,82272823)、国家重点研发计划(2017YFA0205304)、国家转化医学设施(上海)转化医学研究基金(TMSK-2021-117)和上海市自然科学基金(23ZR1434600)的资助。
论文链接:https://www.nature.com/articles/s41467-025-56110-7
研究分享:https://communities.springernature.com/manage/posts/269712





 交大主页
交大主页